
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сведения по электрохимии
|
|
Основные понятия об электролитическом процессе.
Проводники I рода – вещества, в которых, прохождение электрического тока обусловлено свободными электронами.
Пример: алюминиевая шина, стальной штырь, угольный анод, бортовая и подовая угольная футеровка, все металлы, стальной инструмент.
К проводникам II рода относятся водные растворы кислот, щелочей, солей, а также расплавы солей. При прохождении постоянного тока через проводники II рода происходит частичное или полное их разложение с выделением отдельных компонентов на электродах.
Электролитическая диссоциация (разложение) – распад молекул электролитов (кислот, щелочей, солей) на ионы при их растворении, а также расплава солей. Процесс распада на ионы представляет собой реакцию.
Пример:
NaF ↔ N+ + F–; Al2O3 ↔ 2Al3+ + 3O2–.
Электролит – водные растворы кислот, щелочей, солей, содержащие ионы, проводящие в растворённом или расплавленном состоянии электрический ток.
Пример: Расплав солей – криолит – глинозёмный расплав.
Электроды – проводники электрического тока, посредствам которых участок электрической цепи приходящийся на рабочую среду (электролит) соединяется через проводник электрического тока с положительным или отрицательным полюсами источника постоянного тока. Требования: не должны растворятся в рабочей среде.
Пример: угольный анод и расплавленный алюминий электролизёра.
Электролиз – явление выделения компонентов раствора или расплава на электродах при прохождении электрического тока через электролит.
Электролизёр – металлургический агрегат, в котором в процессе электролиза происходит выделение веществ на электродах при прохождении электрического тока через электролит.
Анод – проводник электрического тока, соединённый с положительным полюсом источника тока, на котором протекает окисление.
Катод – проводник электрического тока, соединённый с отрицательным полюсом источника тока, на котором протекает восстановление.
Требования: анод и катод не должны растворяться в электролите, быть хорошими проводниками электрического тока.
Ионное строение криолит-глинозёмного расплава.
При электролитическом получении алюминия в электролизёрах рабочей средой является криолит-глинозёмный расплав, который при высокой температуре разлагается на ионы.
Na3AlF6 – двойная соль – растворитель.
1) 3NaF·AlF3 ↔ 3Na+ + Al3+ + 6F–
2) AlF3 ↔ Al3+ + 3F–
3) Al2O3 ↔ 2Al3+ + 3O2–
4) CaF2 ↔ Ca2+ + 2F–
5) MgF2 ↔ Mg2+ + 2F–
Металлы восстанавливаются на катоде. О2 – выделяется на аноде с образованием оксидов углерода, т.е. происходит горение угольного анода.
С исходным сырьём в электролит попадают оксиды Fe и Si, которые при высокой температуре разлагаются:
6) Fe2O3 ↔ 2Fe3+ + 3O2–
7) SiO2 ↔ Si4+ + 2O2–
Механизм прохождения тока через электролит.
При каждой обработке электролизёра в электролит поступает порция глинозёма, которая в течение определённого времени растворяется и перерабатывается (под действием постоянного электрического тока). Из вышеперечисленных реакций видно, что в электролите в повышенном количестве находятся положительно заряженные ионы Na+ и Al3+ и отрицательно заряженные ионы F– и O2–.
За счёт постоянного электрического тока положительные ионы движутся к отрицательному катоду и называются – катионами, а отрицательные ионы движутся к положительному аноду и называются – анионами.
На электродах происходит разрядка ионов, на анодах разряжаются сначала более электроотрицательные О2– затем F– :
1) 2О2– – 4е → О2 ↑ газ
2) 2F– – 2е → F2 ↑ газ (окисление)
На катоде происходит разряд положительных ионов:
1) Fe3+ + 3е → Fe3+ ↓
2) Na+ + e → Na+ ↓
3) Al3+ + 3e → Al3+↓
4) Si4+ + 4e → Si4+ ↓ (восстановление)
Подведём итог: на аноде выделяются О2 и F2
О2 + С = СО2 + Q (тепло)
СО2 + С = 2СО ↑, который дожигаем в горелках.
2СО + О2 = 2СО2 (в газах ~ 60% СО)
2F2 + 2Н2О (сырьё, вспомогательные материалы) = 4НFгаз + О
2F2 + С = СF4 (C2F6)
на катоде выделяются Fе, Si – ухудшающие сортность металла, а так же Al и Na
Алюминий накапливается в электролизёре, затем извлекается вакуум ковшом.
Натрий частично испаряется, т.к. его температура кипения = 880˚ С частично взаимодействует с угольной футеровкой разрушая её.
Закон Фарадея.
Между количеством прошедшего через раствор (электролит) электричества и количеством выделяющегося элемента существует строго определённое соотношение.
Английский учёный Фарадей установил, что количество, выделенного при электролизе вещества прямо пропорционально силе тока, времени его прохождения через электролит и электрохимическому эквиваленту выделевшегося вещества.
М = К · I · t = 0, 336 · I · t,
где К = 0, 336 – электрохимический эквивалент алюминия (г/А·ч);
I – сила тока (А);
t – время прохождения электрического тока (час).
Пример: I = 150 кА = 150000 А, t = 24 час.
М = 0, 336 · 150000 · 24/1000 = 1209 кг.
На практике выделяется обычно меньше вещества, чем должно выделится по закону Фарадея, т.к. есть потери металла. При электролитическом получении алюминия возникают потери металла за счёт побочных процессов, на которые тратится электроэнергия.
Напряжение разложения.
Конечным результатом электролиза криолит-глинозёмных расплавов являются разложение глинозёма и выделение на катоде алюминия, а на аноде – газообразных оксидов углерода. Но чтобы провести электролиз необходимо подвести к полюсам электролизёра: аноду и катоду, напряжение, превышающее некоторую величину, называемую напряжением разложения.
Под напряжением разложения следует понимать минимальную величину напряжения, необходимую для разложения Al2O3 (практически она составляет 1, 3-1, 7 В).
В общем, падение напряжения на действующем электролизёре – составляющая напряжения разложения достигает 30–40%, остальное напряжение – на преодоление омического сопротивления электролизёра.
Напряжение разложения глинозёма зависит от материала, из которого изготовлен анод. Желателен анод из материала, не вступающего в реакцию с кислородом глинозёма:
Al2O3 ↔ Al + 1, 5О2 (1).5
К таким материалам относятся: платина, ферриты и нитриды – высокая стоимость, которых, исключает их применение. На практике электролиза криолит-глинозёмных расплавов применяются аноды из углеродистых материалов.
Поэтому напряжение разложения глинозёма определяется свободной энергией реакций:
2Al2O3 + 3С ↔ 4Al + 3СО2 (2)
– при угольном аноде напряжение разложения Al2O3 = 1, 167 В;
Al2O3 + 3С ↔ 2Al + 3СО (3)
– при угольном аноде напряжение разложения Al2O3 = 1, 034 В.
Измеренная составляющая падения напряжения на промышленных электролизёрах – 1, 3 - 1, 7 В. Для расчётов принимают 1, 55 - 1, 60 В.
Выделение СО и СО2 на угольном аноде требует перенапряжения, т.к. их образованию препятствует промежуточные кислород углеродные соединения типа СхО. Величина перенапряжения зависит от температуры и состава электролита, плотности тока на аноде и концентрации Al2O3 в электролите.
При повышении температуры перенапряжение уменьшается, при повышении анодной плотности тока и при понижении концентрации Al2O3 – возрастает.
Повышение напряжения разложения может быть вызвано накоплением на катоде натрия и у анодов ионов фтора. Напряжения разложения AlF3, NaF, MgF2, LiF, CaF2 рассчитаны и равны соответственно: 3, 97; 4, 37; 4, 61; 5, 11; 5, 16 В. Эти вещества не разлагаются во время электролиза Al2O3 т.к. имеют большее напряжение разложения, чем Al2O3.
Ряд напряжений (Р.Н.)
Электрохимический ряд напряжений – ряд активности металлов, который показывает их сравнительную активность в реакциях окисления – восстановления. В ряд напряжений включают водород, электродный потенциал которого принимают равным нулю.
Li > K > Ca > Na > Mg > Al > Mn > In > Fe > Co > Ni > Sn > Pb > (H)> Cu > Ag > Hg > Au
-3 -2, 925 -2, 84 -2, 71 -2, 38 -1, 66 -1, 18 -0, 76 -0, 44 -0, 277 -0, 25 -0, 14 -0, 126 +0, 00 +0, 34 +0, 779 +0, 854 +1, 7
1) Каждый металл способен вытеснять из растворов солей все другие металлы, стоящие в ряду напряжений правее данного металла;
2) Чем дальше, расположенные друг от друга два металла в ряде напряжений, тем больше напряжения может давать построенный из них гальванический элемент;
3) Все металлы, расположенные в ряду напряжений левее водорода, способны вытеснять его из кислот, т.е. на катоде в первую очередь будет восстанавливаться металл с более электроположительным электронным потенциалам.
Пример: Ионы Ca2+ препятствуют восстановлению ионов К+ на катоде, поэтому одна из причин использования СаF2 в процессе эксплуатации электролизёра, начиная с момента пуска, является использование его в качестве средства, предотвращающего разрушение углеродистой футеровки.
Механизм катодного процесса.
На катоде согласно ряда напряжения разряжаются ионы, обладающие наиболее положительным потенциалом разряда.
1) Fе3+ + 3е → Fе+ ↓ – восстанавливается до атома Fе и выделяется на катоде.
2) Na+ + e → Na+ ↓
3) Al3+ + 3e → Al3+↓
4) Si4+ + 4e → Si4+ ↓
Однако при относительно большой концентрации ионов натрия (на пусковых электролизёрах, где в электролит добавляют NaСО3 для поддержания требуемого К.О. т.к. происходит интенсивная пропитка футеровки и на горячих ваннах по причине глинозёмистых осадков, которые обрабатывают либо без Al2O3, либо с минимальной загрузкой) на катоде происходит разряд ионов натрия. Этот процесс снижает выход металла, т.к. ток расходуется на выделение натрия. Ионы железа и кремния попадают в электролит с исходным сырьём в виде оксидов и выделяются на катоде, ухудшая сортность алюминия. Температура кипения натрия равна 880º С, а температура электролиза ~ 965º С, то выделившийся натрий на катоде испаряется и сгорает в атмосфере кислорода в горелочном устройстве и даёт спектр пламени с жёлтым оттенком. В итоге на катоде выделяются Al, Na, Fe, Si и другие металлы.
Механизм анодного процесса.
На угольном аноде в первую очередь разряжаются ионы с более электроотрицательным потенциалом разряда и содержание которых в электролите велико.
2О2– – 4е → О2 ↑ газ
Выделившийся кислород, вступает в реакцию с углеродом анода.
С + О2 → СО2 ↑.
Двуокись углерода взаимодействует с углеродом анода и с углеродом осыпавшейся угольной пены поступает в электролите:
СО2 + С → СО ↑ газ,
а также вступает в реакцию с катодным алюминием, который при движении расплава за счёт тепловых потоков и МГД явлений в электролизёре перемешивается с электролитом:
2Al + 3CO2 → Al2O3 + CO ↑ газ.
Анализ состава анодных газов показывает, что они содержат до 60% окиси углерода (СО).
При повышении плотности тока или при снижении концентрации Al2O3 в электролите начинается разряжение ионов фтора:
2F– – 2e → F2 ↑ газ
Частично фтор взаимодействует с углеродом анода:
С + 2F2 → СF4 ↑ газ (фреон), а также C2F6
– эта реакция наблюдается во время возникновения анодного эффекта.
Выделение на аноде соединений фтора приводит к снижению токопроводящей площади поверхности угольного анода и резкому повышению сопротивления на границе анод – электролит.
В итоге выделяется СО2, СО, НF, CF4, С2F6. Рассматривая процессы, протекающие на электродах при электролизе криолит-глинозёмных расплавов, можно сказать, что значительно расходуется компонент Al2O3 электролита и горит угольный анод за счёт кислорода глинозёма. Суммарно реакцию можно записать:
2Al2O3 + 3С → 4Al + 3CO2.
Выход по току – (η т) используется для определения эффективности работы бригады, корпуса и для сравнения с результатами работы других коллективов.
Выход по току – отношение количества металла, фактически полученного при электролизе к его теоретически возможному по закону Фарадея (выражают в процентах):
η т = 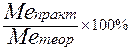 ,
,
где Мепракт – вес фактически полученного металла;
Метеор – количество металла, которое должно выделится на катоде по закону Фарадея.
На практике η т достигает 84-87% для электролизёров с верхним токоподводом тока.
Факторы, влияющие на выход по току.
Выход по току зависит от квалификации электролизников расплавленных солей, анодчиков в производстве алюминия, от уровня технологии в бригаде, корпусе, от совершенства вида ошиновки и модификации электролизёров.
Зависимость выхода по току от температуры электролита.
С увеличением температуры электролита > 965º C увеличивается растворяемость алюминия в электролите и его окисление анодными газами:
2Al + 3CO2 → Al2O3 + 3CO.
Увеличивается перемешивание (движение) электролита и перенос растворённого алюминия к аноду, где он окисляется. Повышение температуры электролита на 10º снижает выход по току на 2–4%, поэтому процесс электролиза следует вести при оптимальной температуре электролита 945-965º C в зависимости от величины К.О.
|
|