
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Складання приладу
|
|
ТЕМА: РЕАКЦІЇ ГАЛОГЕНУВАННЯ
МЕТА: Одержання бромистого етилу (брометану) C2H5Br
РОБОЧЕ МІСЦЕ: ХІМІЧНА ЛАБОРАТОРІЯ
ТРИВАЛІСТЬ ЗАНЯТТЯ: 6 ГОДИН
МЕТА ПРОВЕДЕННЯ ЗАНЯТТЯ:
ЗАКРІПЛЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ З ТЕМИ,
ПІДТВЕРДЖЕННЯ ТЕОРЕТИЧНИХ ЗНАНЬ ПРИ ВИКОНАННІ ЛАБОРАТОРНИХ ДОСЛІДІВ; ОВОЛОДІННЯ МЕТОДОМ СИНТЕЗУ.
МАТЕРІАЛЬНО-ТЕХНІЧНЕ ОСНАЩЕННЯ РОБОЧОГО МІСЦЯ:
Етиловий спирт, бромистий калій, концентрована сульфатна кислота, колби Вюрца, воронки, прилади для перегонки, мірні циліндри.
ПРАВИЛА ОХОРОНИ ПРАЦІ:
Дотримуватися обережності при поводженні з хімічними реактивами, скляним посудом, електричним нагрівальним приладом. При підвищених концентраціях брометан викликає ураження нервової системи.
Реакція галогенування - це процес введення в молекулу органічних сполук атому галогену, при цьому відбувається заміщення деяких функціональних груп на атом галогену.
Речовини, до складу яких входить атом галогену, називаються галогенуючими агентами.
Це галогенводневі кислоти (НСІ, НВг), їх солі (КВг, КСІ) та інші.
Речовини, в молекулу яких вводиться атом галогену - галогенуються. Це спирти, карбонові кислоти, феноли, альдегіди, кетони.
Наприклад: Нуклеофільне заміщення гідроксилу на галоген відбувається при дії галогенідів Фосфору та Сульфуру, а також галогеноводнів H–Hal (HI > HBr > HCl) на спирти за схемою:
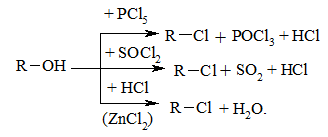
t, H2SO4
R - OH + HX RX + H2O,
де Х- галоген (Cl, Br, I)
Основні реакції:
KBr + H2SO4 KHSO4 + HBr
C2H5OH + HBr C2H5Br + H2O
Побічні реакції:
2НВг + H2SO4 Вг2 + 2H2O + SO2
СН3СН2 - О–SO2 - ОН + НО – СН2СН3 H2SO4 + СН3- СН2- О – СН2СН3
СКЛАДАННЯ ПРИЛАДУ
1. В піщану баню поміщають круглодонну колбу на 250 мл, з’єднують її з дефлегматором і довгим холодильником, до якого приєднують алонж. Кінець алонжа опускають на 1-1, 5 см в суміш води з льодом, налиту в колбу приймач, яку занурюють в льодяну баню (рис.1).
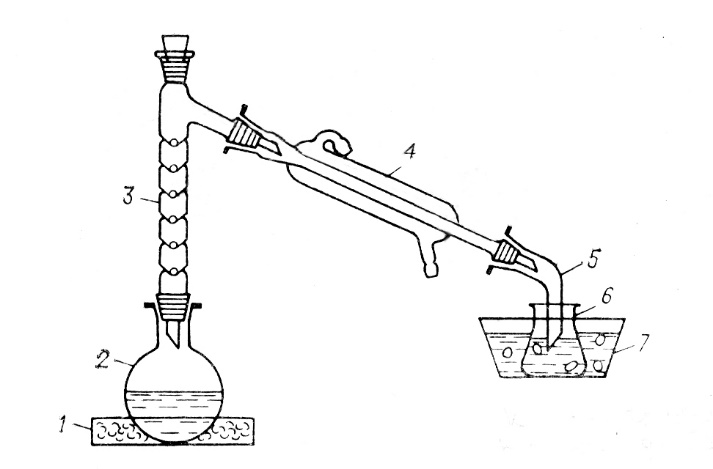 Рис.1. – Прилад для одержання брометану
Рис.1. – Прилад для одержання брометану
| |
ЗМІСТ І ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ:
1. У колбі Вюрца з кипілками змішують 2, 8 мл етилового спирту та 2, 0 мл води, при постійному перемішуванні реакційної суміші і охолодженні колби водою, обережно додають 3, 0 мл концентрованої сульфатної кислоти, а потім 3, 0 г дрібнорозтертого бромистого калію.
2. Збирають прилад для перегонки і нагрівають реакційну суміш на піщаній бані.
3. Відгоняємий бромистий етил збирають у колбу - приймач під шаром води.
4. Після закінчення реакції отриманий бромистий етил з водою виливають у мірний циліндр.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ Й ОФОРМЛЕННЯ:
1. При виконанні дослідів строго дотримуватися кількості реагентів та методики виконання роботи, які вказані в інструкції, а також заходів техніки безпеки.
2. Розрахувати практичний вихід (%) брометану.
3. По закінченню роботи зробити загальний висновок.
ЗАХИСТ РОБОТИ:
Визначити реакції галогенування.
Навести основні і побічні реакції, які відбуваються при бромуванні етанолу.
Навести схему приладу для отримання брометану.
Пояснити основні етапи синтезу брометану.
Пояснити розрахунок виходу продукту.
Яких заходів техніки безпеки необхідно додержуватись при синтезі брометану?
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ:
Привести приклади використання галогенпохідних вуглеводнів.
Пояснити які реагенти використовуються для заміщення гідроксильної групи в спиртах.
В хімічній лабораторії із 100 г етанолу добули 90 г брометану. Визначити практичний вихід.
Пояснити фізико-хімічні властивості бромистого етилу.
Пояснити застосування брометану.
Таблиця - Властивості вихідних речовин і продуктів реакції
| Речовина | Молярна маса | Температура плавлення t, °С | Температура кипіння t, °С | Густина ρ, кг/м3 | Показник заломлення n 20D | Розчинність, s | Примітка |
| Етанол | |||||||
| Калій бромід | |||||||
| Сульфатна кислота | |||||||
| Брометан |
| Змн. |
| Арк. |
| № докум. |
| Підпис |
| Дата |
| Арк. |
| Т 00. 5.05130101.02. ЛР |
|
|