
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Диаграмма состояния.
|
|
Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5)
. 
Рис. 4.5. Диаграмма состояния
Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.
В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус.
По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.
Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4).
По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава.
15. Понятия: компонент, фаза, структурные составляющие, система сплавов
Фазы и структурные составляющие железоуглеродистых сплавов
Фазой называются однородные составные части системы (металла или сплава), имеющие одинаковый состав, кристаллическое строение, свойства и одинаковое агрегатное состояние.
Например, жидкий металл является однофазной системой; смесь жидкого металла и твердых кристалликов – двухфазной системой, так как свойства жидкого металла значительно отличаются от свойств твердых кристалликов. Фазами могут быть отдельные металлы, их химические соединения, а также растворы на основе металлов.
Под структурой понимают форму, размеры и характер взаимного расположения соответствующих фаз в металлах и сплавах.
Структурными составляющими сплава называются обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями. Структурные составляющие могут состоять из одной, двух или более фаз. Одна из важнейших задач металловедения – определение взаимосвязи между составом, структурой и свойствами.
Системой называется совокупность фаз, находящихся в равновесии при определенных внешних условиях (температура, давление). Система, может быть, простой, если она состоит из одного элемента, и сложной, если она состоит из нескольких элементов.
Компонентами называют вещества, образующие систему. Компонентами могут быть элементы (металлы и неметаллы) или устойчивые химические соединения. Чистое железо – металл серебристо-белого цвета с температурой плавления в 1539 °С. Железо имеет две полиморфные модификации: альфа (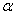 ) и гамма (
) и гамма (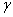 ). Модификация альфа существует при температурах ниже 911 °С и выше 1392 °С; гамма-железо – при температуре 911-1392 °С. В зависимости от температуры и концентрации углерода в железоуглеродистых сплавах (сталях и чугунах) образуются следующие твердые фазы: феррит, аустенит, цементит, графит.
). Модификация альфа существует при температурах ниже 911 °С и выше 1392 °С; гамма-железо – при температуре 911-1392 °С. В зависимости от температуры и концентрации углерода в железоуглеродистых сплавах (сталях и чугунах) образуются следующие твердые фазы: феррит, аустенит, цементит, графит.
1. Феррит (Ф) – твердый раствор внедрения углерода в альфа-железе.
Альфа-железо имеет ОЦК структуру, которая стабильна до 911 °С. Наибольшая растворимость углерода в альфа-железе – 0, 02% при 727 °С. С понижением температуры снижается и растворимость углерода, и при комнатной температуре она составляет 0, 005% по массе. По этой причине феррит называют технически чистым железом, он имеет незначительную твердость (HB = 80-100) и прочность (предел прочности 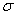 в = 250 МПа), но высокую пластичность (относительное удлинение
в = 250 МПа), но высокую пластичность (относительное удлинение 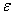 до 50%, относительное сужение
до 50%, относительное сужение 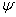 до 80%).
до 80%).
При температуре от 1392 °С до 1539 °С железо также имеет ОЦК структуру - это дельта-железо. Твердый раствор внедрения углерода в дельта-железе называют высокотемпературным ферритом.
2. Аустенит (А) – твердый раствор внедрения углерода в гамма-железе.
Аустенит имеет ГЦК структуру. В железоуглеродистых сплавах аустенит может существовать только при высоких температурах. В гамма-железе углерод растворяется значительно лучше, чем в альфа-железе, максимальная растворимость углерода в гамма-железе составляет 2, 14% и наблюдается при температуре 1147 °С. С пониженим температуры растворимость углерода снижается - до 0, 8% при 727 °С. Аустенит имеет твердость HB = 160-200 и весьма пластичен (относительное удлинение 40-50%), наблюдается в сталях при температурах от 727 °С.
3. Цементит (Ц) – химическое соединение железа с углеродом (карбид железа Fe3C). В цементите содержится 6, 67% углерода. Температура плавления цементита около 1600 °С. Он очень тверд (HB порядка 800 единиц), хрупок и практически не обладает пластичностью. Выделяют цементит первичный, вторичный и третичный. Их отличия заключаются в происхождении:
- первичный цементит образуется из жидкого расплава при кристаллизации железоуглеродистых сплавов (линия СD),
- вторичный цементит выпадает из аустенита (по причине уменьшения растворимости углерода в аустените с понижением температуры - линия SE)
- третичный цементит выпадает из феррита с понижением температуры (по причине снижения растворимости углерода в феррите с понижением температуры - линия PQ)
Цементит - неустойчивая метастабильная фаза. При нагреве и длительной выдержке цементит распадается на феррит (альфа-железо) и графит (Fe3C -> 3Fe + C).
4. Графит – чистый углерод с гексагональной слоистой структурой. Графит очень мягок (HB = 3) и обладает низкой прочностью. В чугунах и графитизированной стали содержится в виде включений различных форм (пластинчатой, хлопьевидной, шаровидной). С изменением формы графитовых включений меняются механические и технологические свойства сплава.
Помимо четырех вышеназванных фаз в струтуре сплавов железа с углеродом выделяют еще две самостоятельные структурные составляющие: перлит и ледебурит.
5. Перлит (П) – механическая смесь феррита и цементита, содержащая 0, 8% углерода.
Перлит образуется из аустенита при охлаждении его до температуры ниже 727 °С. Таким образом, перлит является эвтектоидом. Перлит может быть пластинчатым и зернистым (глобулярным), что зависит от формы цементита и определяет механические свойства перлита. При комнатной температуре зернистый перлит имеет предел прочности 800 МПа, относительное удлинение 15%, твердость HB = 160.
6. Ледебурит (Л) – механическая смесь аустенита и цементита (Л = А+ Ц), содержащая 4, 3% углерода.
Ледебурит образуется из жидкого расплава при температуре 1147 °С. Таким образом, ледебурит по своей сути является эвтектикой. Ледебурит образуется при затвердевании жидкого расплава при 1147 °С. Ледебурит имеет твердость HB = 600-700 HB и большую хрупкость. Ледебурит наблюдается в структуре чугунов, в сталях он образовывается только при большом количестве легирующих элементов и содержании углерода более 0, 7%.
При охлаждении ледебурита до температуры в 727 °С входящий в его состав аустенит становится неустойчивым и распадается, превращаясь в перлит. Таким образом, при температуре менее 727 °С вплоть до 20 °С ледебурит представляет собой механическую смесь перлита с цементитом.
| Феррит | Аустенит | Цементит | Графит | Перлит | Ледебурит | |
| Сущность | твердый раствор внедрения углерода в альфа-железе | твердый раствор внедрения углерода в гамма-железе | химическое соединение железа с углеродом | чистый углерод | механическая смесь феррита и цементита | механическая смесь аустенита и цементита |
| Обозначение | Ф или 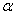 -Fe(C) -Fe(C)
| А или 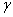 -Fe(C) -Fe(C)
| Ц или Fe3C | Г | П = Ф + Ц = Fe? (C) + Fe3C | Л = А + Ц = Fe? (C) + Fe3C |
| Твердость HB | 80-100 | 160-200 | 600-700 | |||
| Содержание углерода | до 0, 02% | до 2, 14% | 6, 67% | 100% | 0, 8% | 4, 3% |
Фазы и структурные составляющие сплавов железа с углеродом
Помимо перечисленных структурных составляющих, в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: окислы, нитриды, сульфиды, фосфиды – соединения с кислородом, азотом, серой и фосфором.
16. Термический анализ металлов и сплавов
Методы и средства высокотемпературных измерений в литейно-металлургическом производстве используются не только при определении температуры объекта исследования в заданный момент времени, но и для идентификации температур фазовых превращений, при которых происходят процессы, сопровождающиеся либо выделением тепла (например, кристаллизация из жидкости), либо его поглощением (например, плавление, термическая диссоциация). Совокупность таких методов обычно называют термическим анализом. Наиболее общим методом термического анализа является метод построения кривых " время – температура". Нагревая (или охлаждая) изучаемый объект, измеряют через небольшие промежутки времени его температуру; результаты измерений изображают графически, откладывая время по оси абсцисс, а температуру – по оси ординат. При отсутствии превращений кривая нагревания (охлаждения) идёт плавно; превращения отражаются появлением на кривой изломов или горизонтальных участков (" остановок"). Для определения температур фазовых превращений используют дифференциальные зависимости полученных кривых нагревания (охлаждения). Также широко в исследованиях применяется дифференциальный метод термического анализа, по которому нагревание (охлаждение) исследуемого объекта ведут вместе и в одних и тех же условиях с веществом-эталоном, которое в условиях опыта не претерпевает превращений. В этом случае на одном и том же графике записывают и кривую " время – температура", и кривую " время – разность температур" объекта и эталона. Эта разность появляется при любом превращении исследуемого объекта, протекающем с поглощением (выделением) тепла. С помощью термического анализа решается задача получения количественных характеристик (например, фазовый состав, теплота реакций, количество выделившейся фазы) при нагревании (охлаждении) исследуемых объектов. Термический анализ широко применяется при изучении сплавов металлов и сплавов, а также минералов и геологических пород. При этом о характере превращений судят по виду кривой нагревания (охлаждения), а по дифференциальным кривым определяют температуру превращения. Для записи кривых нагревания и охлаждения металлов и сплавов используют различные регистрирующие приборы, в том числе пирометр Н. С. Курнакова, электронные (автоматические) измерительные устройства, оптические пирометры. Для прецизионных (точных) измерений используют тарированные термопары и специальные термометры. Огромный в клад развития методов высокотемпературных измерений внёс выдающийся учёный Н.С. Курнаков. В 1903 г. Н.С. Курнаков создал прибор для термического анализа, автоматически записывающий температурные кривые плавления и затвердения сплавов (пирометр Н.С. Курнакова). Вместо громоздкого прибора Робертса – Аустена он предложил Репозиторий БНТУ легкий, компактный барабанный прибор. «Такого рода аппарат, – отмечал Н.С.Курнаков, – вполне заменяет самого усердного наблюдателя и позволяет улавливать явления, которые по своей непродолжительности ускользают от непосредственного исследования». Пирометр Курнакова нашел широкое применение в лабораториях не только самого ученого, но и многих других металловедов. Так, А.А.Байков в одной из своих работ (1910) писал: «Я решил воспользоваться лучшим регистрирующим прибором для записи и применить его для дифференциального метода, именно – превосходным прибором проф. Н.С.Курнакова».
17. Методика построения диаграмм состояния
Диаграмма состояния представляет собой графическое изображение фазового состояния сплавов данной системы в функции температуры и концентрации (рис. 17).

Рис. 17. Метод построения диаграмм состояния
Левая крайняя точка на оси концентраций соответствует 100 % содержанию компонента А. Процентное содержание второго компонента откладывается по этой оси слева направо. Правая крайняя точка соответствует 100 % содержанию второго компонента В.
Наличие в сплавах промежуточных фаз, образующихся в сплавах в интервале концентраций между чистыми элементами или твердыми растворами на их основе, позволяет рассматривать части диаграммы, между такой фазой и любым из элементов, независимо друг от друга.
Диаграммы состояний строят экспериментально. Для построения диаграммы состояний сплавов, образованных компонентами А и В, необходимо изготовить серию сплавов, содержащих различные количества компонентов А и В. Для каждого такого сплава экспериментально строят кривые охлаждения и определяют по ним критические точки, т. е. температуры фазовых превращений. Полученные значения критических точек изучаемых сплавов откладывают на вертикальных линиях, соответствующих химическому составу этих сплавов. Затем соединяют критические точки, соответствующие определенным фазовым превращениям, и получают линии диаграммы состояний. Линия MKN геометрическое место всех верхних точек, которые определяют температуры началакристаллизации сплавов. Ее называют линией ликвидус (ликва по латыни означает жидкий). Линия MP'N – геометрическое место всех нижних критических точек, которые определяют температуры конца кристаллизации сплавов. Ее называют линией солидус (солид твердый). Эти линии разделяют диаграмму состояний на области определенного фазового состава. Экспериментально построенные кривые охлаждения и диаграммы состояний проверяют по правилу фаз.
Правило фаз устанавливает температурные условия процесса кристаллизации при заданном давлении, а также определяет, сколько фаз должно быть в чистом компоненте или в сплаве определенного состава, если они находятся в равновесном состоянии при данной температуре (или давлении).
Равновесное фазовое состояние сплава определяется составом фаз, температурой и давлением. Число факторов, которые можно менять, не изменяя фазового состава сплава, называют степенью свободы.
Степень свободы C определяется числом компонентов К и числом фаз Ф, имеющихся в сплаве при данной температуре и давлении:
C = К + 2 – Ф
Обычно диаграммы состояний строят для постоянного (атмосферного) давления. В этом случае формула принимает вид:
C = К + 1 – Ф.
Для чистых компонентов степень свободы может принимать значения 0 или 1. В первом случае фазовый состав сохраняется неизменным только при постоянной температуре. Во втором – при изменении температуры. Например, в процессе кристаллизации чистого элемента одновременно существуют две фазы (жидкая и твердая). По правилу фаз можно определить число степеней свободы: С = К + 1 – Ф = 1 + 1 – 2 = 0. Это значит, что процесс кристаллизации чистого элемента пока существуют две фазы, протекает изотермически (рис. 17). Исчезновение одной из фаз (при полном затвердевании или расплавлении) изменяет число степеней свободы С = 1 + 1 – 1 = 1, т. е. на участках кривой охлаждения выше или ниже температуры кристаллизации превращений не будет.
Для двойных сплавов, состоящих из двух компонентов, степень свободы может принимать значения 0; 1 и 2. В процессе кристаллизации такого сплава (см. рис. 17) степень свободы будет равна С = К + 1 – Ф = 2 + 1 – 2 = 1. Это свидетельствует о наличии функциональной зависимости между температурой и концентрацией фаз. Процесс кристаллизации сплава, несмотря на выделение теплоты кристаллизации, протекает при понижающейся температуре, хотя и с меньшей скоростью. Каждой температуре в период кристаллизации соответствует определенная концентрация и количество фаз (правило концентрации и правило отрезков).
При кристаллизации некоторых двойных сплавов (эвтектических, перетектических и др.) количество фаз может быть равным трем. В таком случае С = 2 + 1 – 3 = 0, т. е. процесс протекает изотермически и при постоянной концентрации всех трех фаз.
Правило концентрации устанавливает концентрацию фаз сплава при заданной температуре в период кристаллизации. Концентрация жидкой фазы при данной температуре t1 (см. рис. 17) определяется точкой, лежащей при этой температуре на линии ликвидус, т. е. Жс. Концентрация твердой фазы при этой же температуре определяется точкой, лежащей на линии солидус, т. е. α а.
Таким образом в процессе кристаллизации сплава 1 компонент В в жидкой и твердой фазе распределился неодинаково. Будучи более легкоплавким компонентом, чем компонент А, он в большем количестве сохранился в жидкой фазе и в меньшем количестве вошел во вновь образующиеся твердые кристаллы α. Более тугоплавкий, компонент А в большем количестве сосредоточился в кристаллах α.
Неравномерность распределения компонентов в жидкой и твердой фазе оценивают коэффициентом распределения К = Жс / α а. Это явление легло в основу кристаллофизических методов получения сверхчистых полупроводниковых элементов.
Из всего сказанного можно сделать вывод, что химический состав выделяющихся кристаллов по мере снижения температуры изменяется по линии солидус от точки к' до р '. В это же время состав жидкой фазы изменяется по линии ликвидус от точки к до точки р, т. е. обогащается более легкоплавким компонентом В.
Тем не менее, при очень медленном (равновесном) охлаждении (а все диаграммы строятся именно для этого случая) химический состав твердых кристаллов вследствие процесса диффузии выравнивается и к концу кристаллизации определяется точкой р ', соответствуя химическому составу сплава.
В реальных условиях охлаждения такого выравнивания может и не произойти. В этом случае химический состав одного кристалла в разных его точках может различаться. Такую химическую неоднородность называют микроликвацией.
Правило отрезков устанавливает количественное соотношение фаз в период кристаллизации. Так, например, при температуре t1 (см. рис. 15) количество жидкой и твердой фазы в сплаве определится соотношением
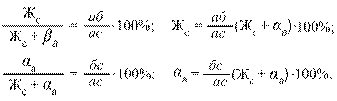
гдеЖс + α а – общее количество сплава.
Таким образом, количество жидкой фазы Жс пропорционально отрезку аб, прилегающему к линии солидус, а количество твердой фазы α а – отрезку бс, прилегающему к линии ликвидус. По мере развития процесса кристаллизации отрезок аб, определяющий количество жидкой фазы, уменьшается, а отрезок бс, наоборот, растет.
18. Свойства компонентов системы Fe-Fe3C
Диаграмма состояния системы железо - углерод является одной из важнейших диаграмм двойных систем, потому что наиболее распространенные в технике сплавы - стали и чугуны - представляют собой сплавы железа с углеродом. В состав сталей и чугунов, кроме углерода, входят кремний, марганец и другие элементы, но углерод является основным компонентом, оказывающим влияние на структуру и свойства железных сплавов.
Следует отметить, что в учебниках по металловедению разных авторов и разных лет издания, которыми пользуются студенты, координаты некоторых основных точек диаграммы несколько отличаются друг от друга по содержанию углерода и по температуре. Это связано с тем, что с течением времени в научной литературе периодически появляются публикации по исследованию отдельных участков диаграммы, уточняющие положение точек и линий диаграммы. Однако эти уточнения обычно невелики, не меняют давно установленного общего начертания диаграммы состояния железо - углерод и не вносят каких-либо принципиальных изменений в понимание фазовых превращений в сплавах и их структуры.
Диаграмма железо – углерод должна распространяться от железа до углерода. Железо образует с углеродом химическое соединение: цементит – Fe3C. Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму – по частям. Так как на практике применяют металлические сплавы с содержанием углерода до 5 %, то рассматриваем часть диаграммы состояния от железа до химического соединения цементита, содержащего 6, 67 % углерода.
|
|