
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Модели атома Томсона и Резерфорда
|
|
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10–10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Zе (Z — порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10–15—10–14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10–10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид 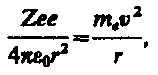 где тe, и v — масса и скорость электрона на орбите радиуса r, e 0 — электрическая постоянная.
где тe, и v — масса и скорость электрона на орбите радиуса r, e 0 — электрическая постоянная.
3. Линейчатый спектр атома водорода
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода.
Швейцарский ученый И. Бальмер (1825—1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
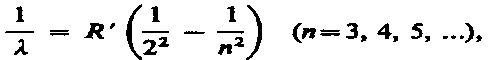
где R '=1, 10× 107 м–1 — постоянная Ридберга.* Taк как n = c / l, то формула может быть переписана для частот:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
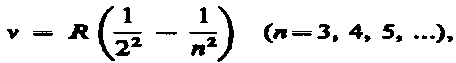
где R=R'c= 3, 29× 1015 с–1 — также постоянная Ридберга.Из выражений вытекает, что спектральные линии, отличающиеся различными значениями п, образуют группу или серию линий, называемую серией Бальмера. С увеличением n линии серии сближаются; значение n = ¥ определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В ультрафиолетовой области спектра находится серия Лаймана:
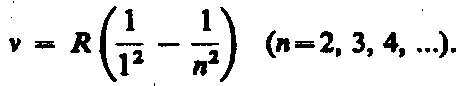
Все серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенном формулой Бальмера:
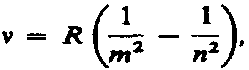
где т имеет в каждой данной серии постоянное значение, m = 1, 2, 3, 4, 5, 6 (определяет серию), п принимает целочисленные значения начиная с т +1 (определяет отдельные линии этой серии).
|
|
