
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Распределительная хроматография.
|
|
13. Вычислите рН раствора, полученного смешением 50 мл 0, 02 М раствора НСООН и 100 мл 1 М раствора НСООNа. КНСООН = 1, 8·10-4.
14. Чем отличаются лиофобные системы от лиофильных?
15. Напишите формулу мицеллы, полученной при взаимодействии избытка хлорида натрия и нитрата серебра. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 22
1. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана С2Н6(г), в результате которой образуются пары воды и оксид углерода (IV). Вычислите, сколько теплоты выделится при сгорании 1 м3 этана.
2. Подтвердите расчетом, что реакция горения ацетилена идет по уравнению С2Н2(г) + 5/2О2(г)= Н2О(ж) + СО2(г) в стандартных условиях.
3. Сколько граммов глюкозы С6Н12О6 должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как у раствора, содержащего в 1 л при этой же температуре 3 г формалина (НСНО)?
4. Составьте схемы двух гальванических элементов, в одном из которых кадмий является анодом, а в другом – катодом. Напишите уравнения реакций, протекающих на электродах
5. Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его ЭДС?
6. Составьте схемы электролиза водных растворов солей K3PO4 и HgCl2 .
7. Какие окислительно-восстановительные процессы протекают у электродов при электролизе соли CuCl2? Какие вещества и в каком количестве выделяются у электродов при прохождении через раствор тока силой 4 А в течение 40 мин?
8. Пластины из меди и никеля соединены алю-миниевыми заклепками. Опишите процессы коррозии, идущие: а) на границе медь-никель; б) на контактах Cu− Al и Ni–Al.
9. Напишите схему получения гальванического покрытия кобальтом на поверхности железа. Сколько времени надо вести электролиз током 2 А, чтобы получить покрытие массой 12 г?
10. Даны металлы: кадмий− марганец. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 7 и 2.
11. Особенность поведения веществ на границе раздела фаз.
12. Осадочная хроматография.
13. Вычислите рН раствора йодноватой кислоты c концентрацией 0, 1 М. КД(НIO3) = 1, 6·10-2.
14. Методы получения коллоидных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата меди (II) с избытком фосфата натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 23
1. При взаимодействии 6, 3 г железа с серой выделилось 11, 31 кДж теплоты. Вычислите теплоту образования сульфида железа (FeS).
2. Рассчитайте, при какой температуре наступит равновесие в системе 4НСl(г) + О2(г) = 2Н2О(г) + 2Сl2(г),
Δ H º r = –114, 2 кДж.
3. Осмотическое давление водного раствора, содержащего 3 г в 250 мл раствора, равно 0, 82 атм при 12оС. Определите молярную массу вещества.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных хромового и вольфрамового электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Составьте уравнения процессов, протекающих на электродах цинк-кадмиевого гальванического элемента в котором С(Zn2+)=C(Cd2+)= 0, 01 М; j0 Zn2+/Zn = − 0, 763 В; j0 Cd2+/Cd = − 0, 13 В.
6. Составьте схемы электролиза водных растворов солей AlCl3 и Hg(NO3)2.
7. Определите, чему равен эквивалент висмута, если для выделения 10 г его из раствора соли надо пропустить через этот раствор 13850 Кл электричества.
8. Приведите по одному примеру катодного и анодного покрытия свинца и опишите схемы процессов коррозии при нарушении каждого из покрытий на свинце.
9. Свинцовый кабель, лежащий в земле, подвергается коррозии блуждающим током силой 50 А. Кабель выйдет из строя, когда растворится 2, 5 кг свинца. Сколько времени может работать кабель?
10. Даны металлы: серебро− железо. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 1 и 9.
11. Что такое адсорбция? Виды адсорбции. Факторы, влияющие на процессы адсорбции.
12. Понятие о катионитах и анионитах.
13. Формиатный буферный раствор имеет рН = 3, 8. Определите концентрацию муравьиной кислоты, если концентрация НСООNа равна 0, 5М, КНСООН = 1, 8·10-4.
14. Методы очистки коллоидных систем от примесей электролитов.
15. Напишите формулу мицеллы, полученной при взаимодействии карбоната калия с избытком хлорида кальция. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 24
1. При получении 1 моль Са(ОН)2 из СаО(к) и Н2О(ж) выделилось 32, 53 кДж тепла. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования СаО (Δ H º f).
2. Сделайте вывод о возможности использования нижеприведённой реакции для получения аммиака в стандартных условиях:
NН4Сl(к) + NаОН(к) = NaCl(к) + Н2О(г) + NН3(г)
3. Раствор, содержащий в 1 л 3, 75 г формалина, обладает осмотическим давлением 2, 8 атм при 0оС. Определите молярную массу формалина.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных магниевого и никелевого электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Определите, что является восстановителем, а что окислителем в гальваническом элементе, состоящем из Cu-Ag электродов. Составьте схему гальванического элемента, уравнения процессов, протекающих на электродах. Рассчитайте ЭДС, если С(Cu2+)=C(Ag+)=1М.
6. Составьте схемы электролиза водных растворов солей ZnSO4 и CaBr2 .
7. Сколько кулонов электричества надо пропустить через раствор соли AgNO3, чтобы выделить 1 г серебра?
8. Никелевая пластинка покрыта слоем свинца. Как будет идти процесс коррозии при нарушении покрытия? Приведите схему процесса.
9. Сколько времени будет работать цинковое покрытие на оцинкованном листе кровельного железа, если защищающая масса цинка 0, 4 кг, а сила коррозийного тока 0, 015 А?
10. Даны металлы: алюминий− платина. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 10 и 6.
11. Уравнение Гиббса, его анализ.
12. Методика разделения смеси ионов.
13. Вычислите рН раствора бромноватистой кислоты с концентрацией 0, 001 н. КД(НВrO) = 2, 2·10-9.
14. Что такое коагуляция и какие факторы ее вызывают?
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата свинца с избытком сульфата натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 25
1. Вычислите изменение энтропии для реакций, которые могут быть описаны уравнениями:
2СН4(г) = С2Н2(г) + 3Н2(г);
С(графит) + О2(г) = СО2(г);
N2(г) + 3Н2(г) = 2NН3(г).
Объясните величину и знак Δ S º.
2. Укажите, какие из приведенных реакций протекают самопроизвольно и являются экзотермическими в стандартных условиях:
а) 2Н2О2(ж) = 2Н2О(ж) + О2(г);
б) 3Н2(г) + N2(г) = 2NН3(г);
в) N2О4(г) = 2NО2(г).
3. Вычислите величину осмотического давления следующих растворов при 0оС: а) 0, 1 н раствора гидроксида калия (α =89%), б) 0, 1 н раствора сульфата натрия (α =69%).
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных свинцового и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg2+ 0, 1 и 0, 01 моль/л.
6. Составьте схемы электролиза водных растворов солей SnBr2 и Al(NO3)3.
7. Каким током (в амперах) велся электролиз раствора CuCl2, если за 1 час было получено 120 граммов меди? Сколько хлора при этом получилось?
8. Сплав олова с цинком опущен в раствор серной кислоты. На каком металле будет выделяться водород? Составьте схему гальванического элемента работающего при коррозии сплавов.
9. Напишите схему получения гальванического покрытия кобальтом на поверхности железа. Сколько времени надо вести электролиз током 2 А, чтобы получить покрытие массой 12 г?
10. Даны металлы: олово− медь. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 8 и 2.
11. Изотерма адсорбции, типы изотерм адсорбции.
12. Жесткость воды, её устранение ионообменной хроматографией.
13. Определите рН буферного раствора, приго-товленного смешением 20 мл 0, 2 М раствора NН4ОН и 50 мл 0, 5 М раствора NН4Сl, если К 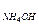 = 1, 8·10-5.
= 1, 8·10-5.
14. Какой ион электролита обладает коагулирующим действием, и как коагулирующая способность связана с зарядом иона?
15. Напишите формулу мицеллы, полученной при взаимодействии силиката калия с избытком хлорида магния. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 26
1. При взаимодействии газообразных сероводорода и оксида углерода (IV) образуются пары воды и сероуглерода CS2(г). Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект в стандартных условиях.
2. Рассчитайте Δ Gº реакции 2Нg2Сl2 = 2НgСl2 + 2Нg и сделайте вывод о возможности самопроизвольного процесса.
3. Одинаково ли осмотическое давление 1 М растворов следующих веществ: глюкозы С6Н12О6, уксусной кислоты СН3СООН и азотной кислоты НNО3? Ответ мотивируйте.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных никелевого и серебряного электродов, jNi2+/Ni = − 0, 23 В; jAg+/Ag = 0, 799 В. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Вычислите потенциал оловянного электрода в растворе, содержащем 2, 58 г SnCl2 в 800 мл раствора.
6. Составьте схемы электролиза водных растворов солей MgSO4 и CuCl2.
7. При электролизе раствора соли за 10 мин на катоде выделилось 0, 26 г хрома. Какова была сила тока? Какой продукт и в каком количестве выделился при этом на аноде?
8. Контакт меди со свинцом находится в растворе HCl. Как будет идти процесс коррозии и на каком из металлов будет выделяться водород?
9. Оцинкованное железо при нарушении цинкового покрытия начинает разрушаться само после растворения 40% площади покрытия. Сколько времени будет осуществляться защитное действие цинкового покрытия, если исходная масса покрытия 400 г, а сила коррозийного тока 0, 02 А?
10. Даны металлы: хром− свинец. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 11 и 7.
11. Поверхностно-активные вещества (ПАВ), особен-ности строения молекул.
12. Практическое значение хроматографии.
13. Рассчитайте рН 0, 6%-ного раствора НNО3 (ρ =1, 022 г/мл).
14. Какое состояние золя называют изоэлектрическим?
15. Напишите формулу мицеллы, полученной при взаимодействии избытка сульфида натрия с хлоридом кадмия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 27
1. При сгорании 23 г этилового спирта выделилось 622, 6 кДж теплоты. Вычислите стандартную энтальпию образования С2Н5ОН.
2. Исходя из величин Δ Gf º соединений, участвующих в реакции, определите возможность самопроизвольного протекания реакции:
Al2O3(к) + 3SO3(г) = Al2(SO4)3(к).
3. Кажущаяся степень диссоциации сернокислого цинка в 0, 1 н растворе равна 40%. Определите осмотическое давление раствора при 0оС.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных цинкового и медного электродов, jZn2+/Zn = − 0, 763 В; jCu2+/Cu = 0, 34 В. Составьте схему гальванического элемента, напишите реакции на электродах.
5. ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0, 47 В. Изменится ли ЭДС, если взять 0, 001 М растворы? Ответ обосновать.
6. Составьте схемы электролиза водных растворов солей Pb(NO3)2 и КС1.
7. Чему равен эквивалент кадмия, если для выделения 1 г его из раствора соли надо пропустить через этот раствор 1717 Кл электричества?
8. Подберите анодное и катодное покрытие для никеля. Опишите коррозийный процесс при нарушении катодного покрытия.
9. Сплав Cu− Pb подвергается коррозии блуждающим током силой 120 А. за сколько времени полностью растворится 18 кг этого сплава (содержит 15% Pb).
10. Даны металлы: титан− цинк. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 2 и 13.
11. Примеры применения ПАВ.
12. Сущность методов хроматографии, их класси-фикация.
13. В 400 мл раствора NаОН содержится 0, 16 г NаОН. Вычислить рН раствора.
14. В чем отличие оптических свойств коллоидных свойств от грубодисперсных и истинных растворов?
15. Напишите формулу мицеллы, полученной при взаимодействии сульфида натрия с избытком хлорида марганца (II). Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 28
1. Определите количество теплоты, которое выделится при взаимодействии 1 моля калия с водой в стандартных условиях.
2. Зная тепловой эффект реакции и стандартные энтропии образования веществ, определите Δ Gº реакции Н2(г) + СО2(г) = СО(г) + Н2О(ж), Δ Hº r = –2, 85 кДж. Сделайте вывод о возможности самопроизвольного процесса.
3. Кажущаяся степень диссоциации раствора азотной кислоты, содержащего 31, 5 г НNO3 в 500 г воды, равна 80%. Рассчитайте температуру замерзания этого раствора.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных никелевого и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Определите восстановитель и окислитель в гальваническом элементе, составленном из хрома, погруженного в 0, 1М раствор Cr(NO)3, и серебра, погруженного в 0, 001М раствор AgNO3. Составьте схему гальванического элемента, напишите уравнения электродных процессов, рассчитайте ЭДС.
6. Составьте схемы электролиза водных растворов солей Na2CO3 и FeCl2.
7. При электролизе водного раствора соли Cr2(SO4)3 током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз? Какой продукт и в каком количестве выделился при этом на аноде?
8. Сплав серебра и меди покрыт слоем золота. Составьте схемы процессов коррозии, идущих при нарушении целостности покрытия. Какие процессы будут идти, если сплав защитить цинковым протектором?
9. Кабель связи защищен свинцовым экраном, который подвергается коррозии блуждающим током силой 50 А. Сколько времени будет работать экран, если он выйдет из строя после растворения 12 кг свинца
10. Даны металлы: магний− марганец. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 4 и 7.
11. Изотерма адсорбции Фрейндлиха. Области при-менения адсорбции.
12. Молекулярно–адсорбционная хроматография.
13. Аммиачно-аммонийный буферный раствор имеет рН = 9, 3. Определите концентрацию NН4ОН, если концентрация NН4Сl составляет 0, 1М, К 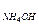 = 1, 8·10-5.
= 1, 8·10-5.
14. В чем заключается практическое значение коагуляции?
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата марганца (II) с избытком сульфида калия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 29
1. Определите стандартную энтальпию образования сероуглерода CS2, если известно, что CS2(ж) + 3О2(г) = СО2(г) + 2SO2(г) – 1075 кДж.
2. Определите возможность самопроизвольного протекания реакции NН3(г) + НСl(г) = NН4Сl(г) при 20°С.
3. Определите температуру замерзания 0, 25 н раствора гидроксида натрия, плотность которого равна
1, 01 г/мл, а степень диссоциации 0, 8.
4. Вычислите ЭДС гальванического элемента, состоящего из серебряного и кобальтового электродов, если [Аg+] = 0, 1 M, а [Со2+] = 0, 001 M (φ 0Co2+/Co = − 0, 277 B, φ 0 Ag+/Ag = 0, 80 B).
5. Вычислите потенциал магниевого электрода, погруженного в 150 мл раствора, содержащего 0, 16 г МgSO4; φ 0 Mg2+/Mg = − 2, 38 B.
6. Составьте схемы электролиза водных растворов солей Rb3PO4 и SnCl2
7. При электролизе раствора соли ZnSO4 за 27 мин на катоде выделилось 3, 25 г цинка. Какова была сила тока?
8. К какому типу покрытий относится олово на стали и на меди? Какие процессы будут протекать при атмосферной коррозии луженых стали и меди в кислой среде? Напишите уравнения катодных и анодных процессов.
9. В качестве протектора для защиты от коррозии сплава Cu-Ni используется цинк. Опишите процессы, за счет которых идет разрушение цинка. За какое время разрушится протектор массой 10 кг, если сила коррозийного тока 0, 05 А?
10. Даны металлы: серебро− хром. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 8 и 3.
11. Адсорбционная способность почв, значение.
12. Сущность распределительной хроматографии.
13. рН уксусной кислоты равен 3, 4. КД(СН3СООН) = 1, 86·10-5. Определите молярную концентрацию экви-валентов этой кислоты.
14. Объясните, какое значение имеет процесс пептизации, и какие вещества могут быть пептизаторами.
15. Напишите формулу мицеллы, полученной при взаимодействии хлорида железа (III) с избытком силиката натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 30
1. При растворении 16 г СаС2 в воде выделяется 31, 5 кДж теплоты. Определите стандартную энтальпию образования Са(ОН)2.
2. Рассчитайте, при какой температуре, 900 или 3000 К, возможна реакция ТiO2(к) + 2С(к) = Тi(к) + 2СО(г).
3. Вычислите степень кажущейся диссоциации 4%-го раствора хлорида калия, если этот раствор начинает замерзать при температуре -2оС.
4. Рассчитайте ЭДС гальванического элемента, составленного из железной и свинцовой пластинок, опущенных в 0, 1 M растворы их азотнокислых солей. Напишите уравнения процессов, протекающих на электродах. (φ 0Fe2+/Fe = − 0, 44 B, φ 0Pb2+/Pb = − 0, 13 B).
5. Вычислите потенциал цинкового электрода, погруженного в 200 мл раствора, содержащего 0, 2 г ZnSО4. (φ 0Zn2+/Zn =− 0, 763 B).
6. Составьте схемы электролиза водных растворов солей Co(NO3)2 и BaС12.
7. Вычислите, сколько времени (в минутах) потребуется для получения 4 г золота при электролизе водного раствора AuCl3 силой тока 4, 5 А.
8. В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите с кислой средой. Составьте уравнения анодного и катодного процессов.
9. Сколько времени будет работать цинковое покрытие на оцинкованном листе кровельного железа, если защищающая масса цинка 0, 5 кг, а сила коррозийного тока 0, 005А?
10. Даны металлы: ртуть− кадмий. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 5 и 9.
11. Значение сорбционных процессов в биологи-ческих системах.
12. Ионообменная хроматография.
13. К 100 мл буферного раствора для изменения рН от 7, 35 до 7 надо добавить 3, 6 мл 0, 5 н раствора НСl. Вычислите буферную емкость по кислоте.
14. Поясните, возможно ли самопроизвольное диспергирование частиц до коллоидных размеров.
15. Напишите формулу мицеллы, полученной при взаимодействии избытка нитрата железа (II) с сульфитом калия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
|
|
