
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ВeCl2 молекуласының гибридтену түрі және кеңістіктегі құрылысы:А) sp, сызықты
|
|
$ С (қ атты)+ 2N2O(г) Û CO2 (г) + 2N2(г)+ Q жү йесiндегi тепе-тең дiктi солғ а ығ ыстыру ү шiн:
В) қ ысымды ө сiредi
$ СN - бө лшегіндегі (МОӘ ә дiсi) байланыс еселiгi:
$ СО молекуласындағ ы (МОӘ ә дiсi) байланыс еселiгi:
С) 3
$ CaCl2 молекуласының гибридтену тү рі жә не кең істіктегі қ ұ рылысы қ андай?
А) sp, сызық ты
$ CaCO3 (қ) Û CaO (қ) + CO2 (г) реакциясының тепе-тең дік константасының ө рнегі:
А) K =РCO2;
$ ClO3- ионы Cl- -на тотық сызданғ анда қ атысатын Н+ моль саны:
Е) 6
$ F2 молекуласының еселік байланысын жә не магниттік қ асиетін анық та:
В) 1 – диамагнитті;
$ Fe(HSO3)3 тұ зының аталуы:
D) темiр (III)три гидросульфиты
$ Fe3O4 (қ атты) + 4CO(г) Û 3Fe(қ атты) + 4CO2 (г) тепе-тең дiкте тұ рғ ан реакция қ ысымын ө сiргендегі тепе-тең дiктің ығ ысуы:
В) ығ ыспайды
$ FeCl3 ерiтiндiсi арқ ылы 2 минут бойы 1, 5 А ток кү шiн жiбергенде катодта бө лінетін темiрдiң массасы:
С) 0, 035 г
$ FeCl3 тұ зының гидролиздену сатысының саны:
С) 3
$ H[Co(NH3)2 (CN)4] комплексті қ осылысындағ ы комплекс тү зушінің заряды мен координациялық саны:
D) 3+ жә не 6
$ H2O – H2S – H2Se – H2Te қ атарындағ ы байланыс ұ зындығ ының ө згерісі:
В) тө мендейдi
$ H2S + Cl2 + H2O ® H2SO4 + HCl реакциясындағ ы тотық сыздандырғ ыштың моль саны:
$ H2S + H2SO3 ® S + H2O тотығ у – тотық сыздану реакциясы кезінде тү зiлген кү кiрттiң моль саны:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
$ K2Cr2O7 + SnCl2 + H2SO4 ® Sn (SO4)2 + CrCl3 + K2SO4 (MK2Cr2O7=294 г/моль; MSnCl2=190 г/моль). Берiлген реакциядағ ы тотық сыздандырғ ыш эквивалентi:
D) 190/2
$ K3[Fe (CN)6] -тегі орталық атомның гибридтену» типін кө рсетің із
D) d2 sp3
$ KМnO4 + Zn + H2O = KOH + MnO2 + Zn (OH)2 реакциясындағ ы тотық тырғ ыштың моль саны:
$ KМnO4 –ң бейтарап ортада тотық сыздану кезіндегі эквиваленттік молярлық массасы:
С) 158/3
$ KМnO4+H2S+H2SO4®MnSO4+K2SO4+S¯ +H2O. Осы реакциядағ ы тотық тырғ ыштың моль саны:
А) 2
$ KМnO4+NaNO2+H2SO4®MnSO4+NaNO3+K2SO4+H2Oтотығ у-тотық сыздану реакциясына қ атысатын электрондар саны:
В) 10
$ KМnO4+NaNO2+КОН®К2MnO4+NaNO3+H2O Т-Тзд р-дағ ы тотық тырғ ыштың моль саны:
В) 2
$ Мg + HNO3 ® Мg (NO3)2 + NH4 NO3 + H2O реакциясындағ ы тотық тырғ ыштың реакцияғ а дейінгі жә не реакциядан кейінгі тотығ у дә режелері:
Д) +5 жә не –3;
$ Mg0+HNO3®Mg(NO3)2+NH4NO3+H2O реакциясындағ ы тотық сыздандырғ ыш алдындағ ы коэффициент:
В) 4
$ Mg (NO3)2 тұ зы ерiтiндiсi электролизiнде анодта бө лiнетiн зат:
С) O2
$ N2+3Н2®2NН3- реакциясы ү шін ә сер етуші массалар заң ының математикалық тең деуi:
$ N2-молекуласындағ ы p-байланысының саны:
С) екi p-байланыс
$ Na2O2+CO2®Na2CO3+O2 реакциясының қ ай типi:
D) диспропорциалану
$ NaBr+NaBrO3+H2SO4®Br2+Na2SO4+H2O Т-Тзд р-дағ ы тотық тырғ ыштың моль саны:
С) 1
$ NaNO3 и K2SO4 тұ здары ерiтiндiлерiнiң қ оспаларын электролиздегенде электродта бө лiнетiн заттар:
D) H2 и O2
$ NH3(г)+HCl(г)=NH4Cl(к) реакциясында DG0298NH3=-16, 48 кДж/моль, DG0298HCl(г)=-95, 3 кДж/моль, DG0298NH4Сl=-203, 22 кДж/моль болғ анда қ алыпты жағ дайда реакцияның ө здігінен жү ру мү мкіндігі:
В) -91, 44; жү редi
$ NiO + H2® Ni + H2O реакция тура бағ ытта жү ргенде, изобара-изотермиялық потенциалдың ө згеруiнің мә ні:
DG0 f,, 298, кДж/моль -212 0 0 -229
А)-17
$ NО + бө лшегіндегі (МОӘ ә дiсi) байланыс еселiгi
$ O2 –мен тотығ у кезінде ЭО2 тү зетін металды кө рсетің із
$ P - элементінің химиялық белгісі:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Д) Ar;
$ рН – мә нi 7-ден ү лкен болатын ерiтiндi:
D) Na2CO3
$ рН=6 тең ерiтiндiдегi сутегi ионы концентрациясы:
В) 10-6
$ рОН=9-ке тең ерiтiндiдегi сутегi ионы концентрациясы (моль/л): А) 10-5
$ s- жә не p-бұ лттарының қ абаттасуы нә тижесiнде тү зiлген молекула:
С) HCl
$ S2- -ионына сә йкес келетiн электрондық формула:
А) 3s23p6
$ 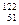 Sb сурьманың min жә не max тотығ у дә режесi:
Sb сурьманың min жә не max тотығ у дә режесi:
В)(-3)-(+5)
$ Zn / Zn2+ (0, 01 моль/л) // Ag+ (0, 01 моль/л) / Ag гальваникалық элементiнiң j0Zn2+/Zn=-0, 76 В; j0Ag+/Ag=+0, 80 B болса, онда ЭҚ К:
А) 1, 50 В
$ Zn/Zn2+ (0, 01 моль/л) // Cd2+ (0, 01 моль/л)/Cd гальваникалық элементiнiң j0Cd2+/Cd=-0, 43 B; j0Zn2+/Zn=-0, 76 B болса, онда ЭҚ К:
В)0, 33 В
ААААА
$ Азоттың тө менгi жә не жоғ арғ ы тотығ у дә режесi:
А) -3; +5
$ Активтілігі жоғ арысы:
D) CdO DH0 f,, 298=-256, 0 кДж/моль
$ Алтын атомы ядросындағ ы нейтрон саны 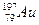 :
:
D) 118
$ Алюминий атомының (
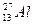 )электрондық формуласы:
)электрондық формуласы:
В) 3s23p1
$ Алюминий катионындағ ы Аl3+ электрондар саны (
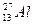 )
)
Е) 10
$ Амфотерлi гидроксидтер орналасқ ан қ атар:
В) Be(OH)2, Zn(OH)2, Cr(OH)3
$ Ауа бойынша газдың салыстырмалы тығ ыздығ ы 1, 5 кезіндегі газдың молярлық массасы (Мауа=29 г/моль):
C) 44
БББББ
$ Байланыс бұ рышы 1200 болатын молекула:
D)AlCl3
$ Барлық d бұ лттарының жапырақ шаларының қ абаттасуынан тү зілген байланыс:
|
|
