
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сірка та її сполуки
|
|
Лабораторна робота №4
Мета роботи: ознайомлення з окисно-відновними властивостями сірки та її сполук.
Дослід 1. Взаємодія сірки з металами
У закріпленій в штативі пробірці нагріти до кипіння трошки сірки і далі щипцями внести в її пару попередньо підігріту смужку мідної фольги. Спостерігати енергійне окиснення міді з утворенням Cu2S. Написати рівняння реакції.
Дослід 2. Окиснення сірки азотною кислотою (під тягою!)
Налити у пробірку 0, 5÷ 1, 0 см3 концентрованої HNO3 і додати невелику кількість порошку сірки. Пробірку помістити на водяну баню і нагріти до кипіння. Спостерігати поступове розчинення сірки. Написати рівняння реакцій.
Дослід 3. Одержання і горіння сірководню
Помістити у пробірку декілька шматочків FeS, додати 2—З см3 сірчаної кислоти (1: 5), закрити пробірку пробкою з газовідвідною трубкою і спостерігати за перебігом реакції. Звернути увагу на колір і запах сірководню. Через 2—З хвилини, коли H2S витисне з пробірки повітря, підпалити його на виході з газовідвідної трубки. Потримати над полум'ям сухий холодний стакан отвором униз. На його стінках конденсуються краплі води. Далі внести у полум'я холодну кришку фарфорового тигля і спостерігати за утворенням жовтого нальоту сірки. Написати рівняння реакцій повного і неповного згоряння сірководню.
Дослід 4. Утворення сірководневої кислоти (під тягою!)
Налити у пробірку З—5 см3 дистильованої води і пропускати протягом 5 хвилин H2S з апарата Кіппа. Нанести краплю добутого розчину на синій лакмусовий папір. Залишити пробірку з сірководневою кислотою до наступного заняття. За цей час H2S частково окисниться киснем повітрям до S°, яка випаде в осад у вигляді каламуті. Написати рівняння реакції.
Дослід 5. Відновні властивості сірководню (лід тягою!)
Налити у З пробірки по 1÷ 2 см³ сірководневої води і додати краплями: у першу пробірку хлорної води, у другу — бромної води, у третю — концентрованої азотної кислоти. У всіх трьох пробірках утворюється вільна сірка у вигляді білої каламуті. Написати рівняння відповідних реакцій.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Дослід 6. Одержання і розчинність оксиду сірки (IV) (під тягою!)
Насипати у пробірку близько 2 г кристалічного Nа2SО3, долити З—5 см3 40% - го розчину H2SO4 і закрити пробірку пробкою з газовідвідною трубкою. Якщо реакція відбувається повільно, пробірку треба трохи підігріти. Сірчистий газ, що виділяється пропустити в другу пробірку з водою. Одержаний розчин сірчистої кислоти використати у наступних дослідах.
Дослід 7. Зміщення рівноваги у розчині сірчистої кислоти
Налити у пробірку приблизно 2 см3 сірчистої кислоти і додати розчин лакмусу до забарвлення рідини. Нагріти на газовому пальнику розчин, що міститься у пробірці, до кипіння. Пояснити причину зміни забарвлення розчину під час тривалого кип’ятіння.
Дослід 8. Відновні властивості сірчистої кислоти та її солей (під тягою!)
Помістити у п’ять пробірок по 5—8 крапель розчину H2SO3 і додати по 5—8 крапель розчину сірчаної кислоти, а далі по З—5 крапель: у 1 пробірку
— бромної води; у 2 — йодної води; у З — 1—2 краплі Н2О2; у 4 — З—5 крапель розчину КМnО4; у 5 — З—5 крапель розчину К2СI2О7. Що спостерігається? Те саме виконати, взявши замість сірчистої кислоти розчин сульфіту натрію.
Дослід 9. Окисні властивості сірчистої кислоти (під тягою!)
Помістити у пробірку 5—8 крапель сірчистої кислоти і додати таку ж кількість сірководневої води. Спостерігати утворення каламуті вільної сірки. Написати рівняння реакції.
Дослід 10. Нестійкість тіосірчаної кислоти
До 5 крапель розчину тіосульфату натрію додати рівний об'єм розчину хлористоводневої кислоти. Чим пояснити появу каламуті? Зобразити графічну формулу тіосульфату натрію. Написати рівняння реакції, для якої потрібно складати електронний баланс.
Дослід 11. Відновні властивості тіосульфату натрію (під тягою!)
Налити у пробірку 2—З см3 дистильованої води, розчинити в ній невелику кількість тіосульфату натрію. Розчин розділити на 2 пробірки. Додати в одну з них декілька крапель хлорної води і переконатися в тому, що запах хлору зник. Довести наявність іонів S042- у розчині за допомогою розчину ВаСІ2.
До розчину у 2 пробірці додати З—5 крапель йодної води і спостерігати за знебарвленням розчину йоду. Написати рівняння реакцій, враховуючи, що йод окислює Na2S203 до тетратіонату натрію Nа2S406
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Дослід 12. Обвуглювання папірусу сірчаною кислотою
Змочити скляну паличку розведеною H2SO4 і цією паличкою написати будь-що на білому аркуші паперу. Висушити написане над полум'ям пальника. Спочатку на папері майже нічого не видно, а далі на білому фоні чітко виступають чорні літери. Пояснити причину цього явища.
Дослід 13. Взаємодія сірчаної кислоти з цинком (під тягою!)
Помістити у дві пробірки по одному шматочку металічного цинку, додати у 1 пробірку декілька крапель розведеної, а у 2 — концентрованої сірчаної кислоти. У 1-й пробірці реакція відбувається енергійно з виділенням газу. Чи має запах цей газ? Заповнити ним суху пробірку, тримаючи її уверх дном, і піднести її отвором до полум'я пальника. Що при цьому спостерігається? Який це газ? Зверніть увагу на те, що у концентрованій сірчаній кислоті цинк майже не розчиняється. Трохи підігріти пробірку і спостерігати за перебігом реакції. Чи має запах газ, що виділяється? (Обережно!) Підігріти пробірку сильніше і спостерігати за утворенням у розчині каламуті сірки. Звернути тепер увагу на запах газу що виділяється.
Написати рівняння реакцій, враховуючи, що концентрована сірчана кислота залежно від температури може відновлюватися цинком до оксиду сірки (IV), вільної сірки та сірководню.
Питання для самоконтролю
1. Показати всі можливі ступені окиснення сірки в сполуках. При яких ступенях окиснення сірка має двоїсті окисні та відновні властивості? Навести приклади.
2. Написати рівняння реакцій одержання сульфідів різними способами.
3. На які групи поділяють сульфіди за розчинністю?
4. Чому H2S і його похідні виявляють тільки відновні властивості?
5. Дати характеристику сірчистому газу. Де використовують SO2 і гідросульфіти лужних металів?
6. Одержання сірчаної кислоти. Утворення гідратів сірчаної кислоти.
7. Назвати сфери застосування солей сірчаної кислоти.
8. Показати на прикладах окисні властивості сірчаної кислоти.
Лабораторна робота №5
АЗОТ ТА ЙОГО СПОЛУКИ
Мета роботи: навчитися синтезувати азот, аміак, кисневмісні сполуки азоту, вивчити їх властивості та властивості азотистої і азотної кислот.
Дослід 1. Одержання азоту
У пробірку помістити приблизно 1 г кристалічного NaN02 і додати З— 4 см3 насиченого розчину NH4C1. Пробірку закрити пробкою з газовідвідною трубкою (рис.1) і обережно нагріти
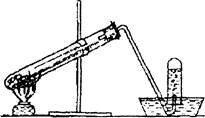 |
Рис. 1. Прилад для одержання азоту.
Газ, що утворюється, збирають у пробірку над водою. Після витискання води із пробірки азотом, що виділився, закрити під водою отвір пробірки пальцем і вийняти пробірку з води. У пробірку з газом опустити запалену скіпку. Що спостерігається? Написати рівняння реакцій одержання азоту з нітриту натрію і хлориду амонію.
Дослід 2. Одержання аміаку і вивчення його властивостей
У суху пробірку з газовідвідною трубкою внести приблизно З г розтертої суміші (1: 1) кристалічного хлориду амонію і сухого гідроксиду кальцію. На другий кінець трубки надіти суху пробірку і нагріти пробірку з сумішшю (рис. 2).
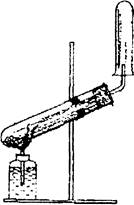 |
Рис. 2. Прилад для одержання аміаку.
Піднести до кінця газовідвідної трубки: а) рожевий лакмусовий папірець, змочений водою, і пояснити зміну його забарвлення; б) скляну паличку, змочену концентрованою соляною кислотою, і спостерігати утворення білого нальоту хлориду амонію; скласти рівняння реакцій одержання аміаку; взаємодії аміаку з водою і соляною кислотою; в) пробірку з аміаком зняти з газовідвідної трубки, закрити її отвір пальцем і опустити у чашку з водою. Спостерігати підіймання води у пробірці. Пояснити це явище.
Дослід З. Властивості водного розчину аміаку
А. На предметне скло нанести 2-3 краплі водного розчину аміаку, додати і краплю розчину фенолфталеїну. Про які властивості розчину аміаку свідчить забарвлення індикатора?
Б. У пробірку внести 2—З краплі водного розчину аміаку і додати таку ж кількість розчину сульфату заліза (II). Написати рівняння реакції.
Дослід 4. Якісна реакція на іон амонію
Внести у пробірку 5—6 крапель розчину хлориду амонію, додати 3—4 краплі розчину гідроксиду натрію і підігріти. Над пробіркою, не торкаючись її стінок, потримати змочений водою рожевий лакмусовий папірець. Що спостерігається? Який газ виділяється? Написати рівняння реакції.
Дослід 5. Одержання оксиду азоту (II) і вивчення його властивостей
У пробірку насипати дрібку мідних стружок і налити 1—2 см3 розведеної азотної кислоти. Пробірку закрити корком з газовідвідною трубкою і обережно підігріти. Зібрати газ, що виділився над водою, у другу пробірку, як показано на рис. 1. Наповнену газом пробірку закрити пальцем і вийняти із води. Звернути увагу на колір газу. Написати рівняння реакції. Відкрити пробірку і спостерігати зміну забарвлення газу. У ту саму пробірку натити води, збовтати. Середовище розчину випробувати лакмусом. Написати рівняння реакцій.
Дослід 6. Одержання оксиду азоту (IV) і вивчення його властивостей (під тягою!)
У пробірку внести дрібку мідних стружок і додати невелику кількість концентрованої азотної кислоти. Зібрати газ, що виділяється, у три пробірки. Закрити пробірки з газом пробками і використати для наступного:
а) випробувати чи горять в оксиді азоту (IV) тліюча скіпка і запалений червоний фосфор;
б) у пробірку з оксидом азоту (IV) налити 1 см3 води і збовтати. Випробувати розчин лакмусом. Написати рівняння реакції оксиду азоту (IV) з водою.
Дослід 7. Одержання азотистої кислоти
У пробірку внести щіпку кристалічного нітриту натрію або нітриту калію, додати 1—2 см3 води і 5—10 крапель розведеної сірчаної кислоти. Відмітити колір розчину і колір газу над ним. Пояснити, яка речовина надає забарвлення розчину, який склад газу. Написати рівняння реакцій.
Дослід 8. Окисні і відновні властивості азотистої кислоти (нітритів)
А. Налити у пробірку З—5 крапель розчину КІ, підкислити його 1—2 краплями розведеної H2SO4 і далі додати 2—3 краплі розчину NaN02.
Пояснити зміну забарвлення розчину. Які властивості виявляє NaN02 у цій реакції? Написати рівняння реакції.
Б. Налити у пробірку 1—2 краплі розчину КМnО4, підкислити йог о 1— 2 краплями розчину H2SO4 і додати 5—7 крапель розчину NaN02. Які властивості у цій реакції виявляє NaN02? Написати рівняння реакції.
Дослід 9. Окисні властивості азотної кислоти (під тягою!)
А. Дія концентрованої азотної кислоти на метали. В одну пробірку помістити гранулу цинку, у другу шматок стружки міді, додати у кожну з них по декілька краплин концентрованої азотної кислоти. Який виділяється газ? Написати рівняння відповідних реакцій.
Б. Дія розведеної азотної кислоти на метали. Помістити у пробірку дрібку магнію і додати декілька краплин сильно розведеної азотної кислоти, збовтати протягом декількох хвилин, далі злити розчин і довести наявність у ньому іонів NH4". Написати рівняння реакцій.
Дослід 10. Розкладання нітратів при нагріванні
Взяти дві пробірки, в одну з них помістити декілька кристаликів нітрату натрію (NaNO3), у другу — нітрату міді (Сu(НОз)2 • ЗН2О). По черзі сильно нагріти кожну із пробірок. У кожну пробірку внести тліючу скіпку. Що спостерігається? Написати рівняння реакцій.
Питання для самоконтролю
1. Яким чином відбувається зв’язування азоту з атмосфери і накопичення його сполук у ґрунті?
2. Охарактеризувати положення азоту в періодичній системі Д.І.Менделєєва. Написати електронну формулу атома азоту. З точки зору будови атома розглянути можливі валентні стани та ступені окиснення азоту.
3. Написати рівняння реакцій одержання азоту шляхом відновлення нітратів; шляхом окиснення аміаку.
4. Як здійснити наступні перетворення:
N2 ↔ NH4 → NO
↓
NH4NO3 ?
5. Написати рівняння реакцій, що характеризують взаємодію HNO3 з металами.
6. Які сполуки азоту знаходять використання у сільському господарстві?
7. Яка хімічна суть процесів амоніфікації та нітрифікації?
Лабораторна робота №6
ФОСФОР. ХІМІЧНІ ВЛАСТИВОСТІ СПОЛУК ФОСФОРУ
Мета роботи: провести якісні реакції на іони фосфорних кислот, навчитися синтезувати фосфорні кислоти і вивчити їх властивості
Дослід 1. Вивчення якісних реакцій на іони фосфорних кислот
A. До З—5 крапель розчину молібденової рідини додати 5—6 крапель розчину Н3РО4 або її солі. Суміш нагріти на водяній бані. Що спостерігається, який вид і колір осаду утворися?
Б. До З—5 крапель розчину гідрофосфату натрію додати 2—З краплі AgNO3. Який вид і колір осаду, що утворився? Як відноситься цей осад до дії HNO3? Написати рівняння відповідних реакцій.
B. До декількох крапель розчинів мета- і пірофосфатів натрію в окремих пробірках додати по декілька крапель розчину AgNO3. Випробувати відношення осадів до розчину HNO3. Написати рівняння відповідних реакцій.
Г. Взяти по декілька крапель розчину яєчного білка у воді в двох пробірках, додати: у першу пробірку декілька крапель розчину метафосфату натрію, у другу — стільки ж пірофосфату натрію, далі у кожну пробірку додати декілька крапель розчину СН3СООН. У пробірці із метафосфатом натрію спостерігається скипання білка. На підставі виконаних дослідів зробити висновок про те, як можна відрізнити іони фосфорних кислот Р042-, Р2О74-, РО3-.
Дослід 2. Одержання фосфорних кислот (під тягою!)
А. Одержання фосфорних кислот із оксиду фосфору (V).
Дрібку порошку Р2О5 внести у пробірку, додати 2—З см3 холодної дистильованої води. Коли розчин стане прозорим, відлити 1—1, 5 см3 у другу пробірку, нейтралізувати цю частину розчину до слабокислої реакції (контроль лакмусовим папірцем), додаючи краплями розчин соди. Довести,
яка кислота утворилася в результаті досліду. Написати рівняння реакцій, що відбулися. До частини розчину кислоти, що залишився у першій пробірці, додати З—4 см3 води і 0, 5—1 см3 концентрованої HNO3, суміш нагрівати 10 хвилин на водяній бані. Відлити половину цього розчину у вільну пробірку, додати 5—6 крапель молібденової рідини і нагрівати йде 5 хвилин на водяній бані. Записати спостереження, дати пояснення реакціям, які відбулися, і скласти необхідні рівняння.
Б. Одержання ортофосфорної кислоти окисненням червоного фосфору.
Крихту червоного фосфору нагріти у фарфоровій чашці з 4—5 см3 концентрованої HNO3. Якщо фосфор прореагував не весь, додати ще трошки HNO3. Частину розчину, що утворився, відлити в окрему пробірку, додати туди 5—6 крапель молібденової рідини і нагріти на водяній бані протягом 5 хвилин. Яка кислота утворилася в результаті досліду? Написати рівняння реакції.
Дослід 3. Гідроліз солей ортофосфорної кислоти
У три пробірки налити по 1—1, 5 см3 дистильованої води. Розчинити по декілька кристаликів: у першій пробірці — фосфату натрію Na3P04, у другій — гідрофосфату натрію Na2HP04, у третій — дигідрофосфату натрію NaH2P04. За допомогою універсальних індикаторних папірців виміряти рН розчинів у кожній пробірці. Пояснити характер зміни рН у всіх випадках. Написати відповідні реакції у молекулярному та іонному вигляді.
Дослід 4. Розчинність кальцієвих солей ортофосфорної кислоти
У три пробірки з 5—6 краплями розчину СаСI2 додати таку ж кількість розчинів: у першу — Мn3Р04, у другу — Na2HP04, у третю — NaH2P04. Спостерігати утворення осадів у перших двох пробірках. Пояснити, чому у третій пробірці осад не утворився. Додати у першу та другу пробірки по 5—6 крапель розчину НСI і слідкувати за розчиненням осадів. В якій пробірці
осад розчиняється швидше і чому? Написати рівняння всіх реакцій, що відбулися.
Дослід 5. Одержання суперфосфату
Відважити на технічних терезах 10—15 г фосфориту, подрібненого у порошок, і перенести його у стакан. Дізнатись у викладача про вміст Са3(Р04)2 У фосфориті і розрахувати масу Са3(Р04)2 у взятій наважці. Обчислити, скільки концентрованої сірчаної кислоти з густиною 1840 кг/м3 необхідно взяти для перетворення фосфориту у суперфосфат. Відміряти необхідний об'єм кислоти, розвести її водою у співвідношенні 1: 1. Розчин H2SO4 вилити невеликими порціями у стакан з фосфоритом і перемішувати скляною паличкою реакційну суміш З—5 хвилин. Скласти та пояснити всі реакції цього процесу.
Питання для самоконтролю
1. Колообіг фосфору у природі.
2. Назвати алотропні модифікації фосфору і дати їм порівняльну характеристику.
3. Зобразити графічні формули оксидів фосфору (III) і (V). Які їх хімічні властивості?
4. Які ступені окиснення проявляє фосфор у таких сполуках: РН4СІО4, Ва(Н2Р02)2, Аg2НРО3, Na4P207, NaPF6, Са(Н2Р04)7?
Чим пояснити те, що при взаємодії фосфорного ангідриду з водою спочатку утворюється (НРОз)n, далі Н4Р2О7 і як кінцевий продукт - Н3РО4?
5. Які іони присутні у розчині ортофосфорної кислоти? Написати рівняння процесів її дисоціації.
6. Як фосфорні добрива поділяються за розчинністю?
7. Яке значення фосфору як кормової добавки?
8. Чому фосфорити доцільніше використовувати як добрива на кислих ґрунтах, ніж на нейтральних?
Лабораторна робота №7
ХЛОР ТА ЙОГО СПОЛУКИ
Мета роботи: ознайомлення студентів з методами одержання хлору, вивчення якісних реакцій на іон хлору, властивостей хлорної води, хлоридної та хлоратної кислот.
Дослід 1. Одержання хлору (під тягою!)
A. Помістити у пробірку 2—З кристали перманганату калію і поставити її у штатив. Обережно додати декілька крапель концентрованої соляної кислоти. Який газ виділяється (визначити за запахом і за кольором)? Написати рівняння реакції.
Б. У пробірку насипати трохи дихромату калію і додати 5—10 крапель концентрованої соляної кислоти. Суміш легко підігріти. Що спостерігається? Написати рівняння реакції.
B. Помістити у пробірку трохи суміші хлориду натрію і оксиду марганцю (IV). Обережно додати піпеткою 5—8 крапель концентрованої сірчаної кислоти. Суміш легко підігріти. Що спостерігається? Написати рівняння реакції.
Г. Помістити у пробірку трохи хлорного вапна і облити його 20% -ним розчином соляної кислоти (концентрована соляна кислота, розведена удвічі). Що спостерігається? Написати рівняння реакції.
Дослід 2. Властивості хлорної води.
У чотири пробірки помістити: в першу— краплю розчину фуксину, в другу — краплю розчину індиго, у третю пробірку — шматочок блідо забарвленої бавовняної тканини, в четверту — лакмусовий папірець. Додати у кожну пробірку по 3-4 краплі хлорної води. Провести спостереження через 10 - 15 хвилин.
Для порівняння опустити сухий лакмусовий папірець і суху бавовняну тканину у пробірки з сухим газоподібним хлором, тримаючи їх щипцями. У чому різниця між дією хлорної води і сухого газоподібного хлору? Чим вона пояснюється?
Дослід З. Окисні властивості хлорної води
А. Налити у дві пробірки по 1 см3 розчинів броміду калію та йодиду калію. У кожну пробірку додати 0, 3 — 0, 5 см3 бензолу. Збовтати. Звернути увагу на колір бензольного шару. Додати у кожну пробірку по 0, 5 см3 хлорної води. Енергійно збовтати. Чи змінився колір бензольного шару? Написати відповідні рівняння реакцій,
Б. До 1 см3 розчину сульфіду натрію долити 0, 5 см3 хлорної води. Що спостерігається? Написати рівняння реакції.
Дослід 4. Якісна реакція на іон хлору
У три пробірки налити по З—4 краплі розчинів наступних хлоридів: у першу — хлориду калію, у другу — хлориду барію, у третю — хлориду заліза (ІІГ). У кожну пробірку додати по 2 краплі розчину нітрату срібла. Порівняти результати спостережень у всіх трьох пробірках. Що між ними спільного? Скласти рівняння реакцій, що відбулися.
У всі пробірки додати по 1—З краплі концентрованого розчину аміаку і розмішати. Що відбувається з осадом? Чому осад у третій пробірці не розчинився? Що сталося з його кольором?
Додати у кожну пробірку по 1—З краплі концентрованої азотної кислоти. Які зміни відбуваються? Що можна сказати про поведінку хлориду срібла в аміаку і кислому середовищі?
Дослід 5. Одержання хлористого водню і соляної кислоти
У суху пробірку помістити 1—2 г хлориду натрію і долити 1 см3 концентрованої сірчаної кислоти. Закрити пробірку газовідвідною трубкою. Опустити кінець трубки до дна, а у другу суху пробірку — газоприймач. Закрити отвір тампоном вати. Поряд поставити стакан з дистильованою водою. Реакція починається без нагрівання, а завершити її потрібно при слабкому підігріванні. Реакцію закінчити при появі над ватою туману з краплинок соляної кислоти, що утворюється від сполучення хлористого водню з вологою повітря. Налити у пробірку-газоприймач З—4 см3 води, розчин розділити на дві пробірки. Одну пробірку випробувати синім лакмусовим папірцем, у другу додати 3—4 краплі AgN03.
Записати спостереження і зробити висновки.
Дослід 6. Взаємодія соляної кислоти з металами
У три пробірки помістити: у першу — 1—2 гранули цинку, у другу — трохи залізних стружок, у третю — мідних стружок. У кожну пробірку додати розведеної соляної кислоти і спостерігати, які з цих металів взаємодіють із соляною кислотою. Скласти рівняння реакцій, що відбулися.
Дослід 7. Окисні властивості хлорного вапна
A. До 1 см3 підкисленого розчину фуксину або індиго додати краплинами насичений розчин хлорного вапна і спостерігати за знебарвленням розчину.
Б. До 1 см3 підкисленого розчину йодиду калію додати краплями насичений розчин хлорного вапна і спостерігати за виділенням вільного йоду. Додати кілька крапель розчину крохмалю. Що при цьому спостерігається? Написати рівняння реакції.
B. Налити у пробірку 1 см3 розчину сульфату заліза (II). Додати такий самий об'єм лугу. Відмітити колір осаду, що утворився. Скласти рівняння реакції. Одержаний розчин з осадом збовтати і додати 0, 5— 1 см3 насиченого
розчину хлорного вапна. Чому змінився колір осаду? Скласти рівняння реакції.
Г. Помістити у пробірку З—5 крапель ацетату свинцю і трохи сухого хлорного вапна. Пробірку підігріти. Відмітити утворення осаду діоксиду свинцю та його колір. Написати відповідне рівняння реакції.
Дослід 8. Окисні властивості хлоратної кислоти
А. У дві пробірки налити рівні об'єми розчинів КСІО3 і КІ (по 1 см3). В одну з пробірок додати трохи розчину H2SO4. Що відбувається? Порівняти колір розчинів в обох пробірках. Написати рівняння реакцій і пояснити результати досліду, враховуючи, що окисні властивості у розчині характерні лише для НСІО3, а не для її солей.
Б. Невеликі кількості розтертих до дрібного порошку хлорату калію і сірки обережно змішати на аркуші глянсового паперу скляною паличкою, а потім висипати суміш у паперовий пакетик. Покласти його на тверду підкладку (залізну пластину) і різко вдарити молотком. Чому суміш вибухає? Написати рівняння реакції.
Питання для самоконтролю
1. Виходячи з розташування хлору у періодичній системі і будови атома, охарактеризуйте його окисні і відновні властивості.
2. У чому принципова сутність одержання вільного хлору з його сполук? Навести приклади відповідних реакцій.
3. Охарактеризувати фізіологічні властивості хлору в рослинних і тваринних організмах.
4. Співвіднести кислоти: НСІО, НСІО2, НСІО3, НСІО4 та оксиди:
СІ2О, СІО2, СІ2О6, СІ2О7 як кислоти та їх ангідриди.
5. Закінчити рівняння реакцій, скласти електронний баланс і підібрати коефіцієнти:
КМnО4 + HCI →
Рb02 + HCI →
К2СI2О7 + HCI →
МnО2 + NaCl + H2SO4 →
6. Порівняти стійкість, реакційну здатність, окисні і відновні властивості в ряду кислот НCIO - НCIО4.
7. Дати оцінку хлору в природі та в сільському господарстві.
Лабораторна робота №8
ОДЕРЖАННЯ ЙОДУ, ХІМІЧНІ ВЛАСТИВОСТІ ЙОДУ І ЙОГО
СПОЛУК
Мета роботи: навчитися проводити реакції одержання йоду, сублімацію йоду, вивчити його окиснювально-відновні властивості і властивості його сполук.
Дослід 1. Одержання йоду
А. У сухій пробірці змішати декілька кристалів йодиду калію з невеликою кількістю Мn02, додати до суміші 2—З краплі концентрованої сірчаної кислоти. Якщо реакція відбувається повільно, пробірку трохи підігріти. Спостерігати виділення газоподібного йоду у вигляді фіолетової пари.
Б. У дві пробірки з розчином йодиду натрію або калію додати по 4— 5 крапель бензолу або чотирихлористого вуглецю. В одну з пробірок долити З—5 крапель хлорної води, в другу — таку ж кількість бромної води. Розчини збовтати. Якого набув шар органічного розчинника?
Дослід 2. Сублімація (возгонка) йоду
Возгонку йоду виконують у сухому хімічному стакані, на дно якого покладено декілька кристалів йоду. Стакан закривають фарфоровою чашкою з холодною водою, ставлять на азбестову сітку і повільно нагрівають до появи фіолетової пари йоду. На холодних стінках стакана і на дні чашки збираються кристали сублімованого йоду.
Дослід 3. Розчинність йоду у воді, спирті та у водному розчині йодиду
калію
Помістити у дві пробірки декілька кристалів йоду. В одну пробірку додати 1 см3 дистильованої води, в другу пробірку — такий же об'єм
етилового спирту, збовтати. Спостерігати різне забарвлення рідин. У першу пробірку до водного розчину, в якому знаходяться кристалики йоду, що не розчинилися, додати декілька крапель йодиду калію, збовтати. Що спостерігається? Як змінюється забарвлення розчину? Порівняти розчинність йоду у воді, спирті, водному розчині йодиду калію. Зробити висновки.
Написати рівняння реакції, що відбувається при розчиненні йоду у розчині йодиду калію з утворенням полійодиду.
Дослід 4. Йод-крохмальна реакція, її чутливість до нагрівання
У пробірку налити 8—10 крапель йодної води і додати 1—2 краплі розчину крохмалю. Відмітити забарвлення розчину. Нагріти пробірку на водяній бані до 80°С. Як змінилося забарвлення? Розчин охолодити до кімнатної температури. Що відбувається із забарвленням розчину після охолодження?
Пояснити синє забарвлення йодної води при додаванні розчину крохмалю. Чому зі зміною температури забарвлення зникає і знову з'являється? Зробити висновок.
Дослід 5. Взаємодія йоду з металами
A. У дві пробірки внести окремо по 5—8 крапель йодної води. Додати по 1 мікрошпателю порошку цинку та магнію. Спостерігати знебарвлення розчинів. Написати відповідні рівняння реакцій, вказати окисник і відновник.
Б. У фарфоровій чашечці змішати порошок алюмінію з дрібно розтертим йодом у співвідношенні 1: 3. До суміші за допомогою піпетки додати 1 краплю води. Спостерігати екзотермічну реакцію. Написати рівняння, вказати окисник і відновник. Пояснити роль води у цій реакції.
В. Очищену від іржі залізну пластинку покрити лаком. Тонкою голкою зробити напис так, щоб голка дійшла до поверхні заліза. Далі нанести на пластинку розчин йоду в йодиді калію і через З—5 хвилин змити розчин йоду водою, а лак — органічним розчинником. Опишіть спостереження.
Складіть рівняння реакції, якщо відомо, що утворюється сполука заліза і з ступенем окиснення 2.
Дослід 6. Окиснення сірководню йодом
У пробірку помістити 5—6 крапель йодної води і додати 5—6 крапель свіжоприготовленої сірководневої води до зникнення забарвлення йодної води. Спостерігати помутніння розчину. Чим це зумовлено? Написати відповідне рівняння реакції.
Дослід 7. Відновні властивості йодид-іонів
А. Внести у пробірку 2—3 краплі розчину хлориду заліза (III) і додати 2—З краплі бензолу (або тетрахлориду вуглецю). Додати 1—2 краплі розчину йодиду калію або натрію, збовтати. Спостерігати забарвлення бензольного шару. Написати рівняння реакції.
Б. Помістити у пробірку 2—3 краплі розчину К2СІ2О7, додати таку саму кількість розведеної сірчаної кислоти і З—4 краплі бензолу. До цієї суміші додати 2—З краплі йодиду натрію або калію, суміш збовтати. Пояснити забарвлення бензольного шару у малиново-фіолетовий (фіалковий) колір. Скласти рівняння реакції, вказати окисник та відновник.
Дослід 8. Окисні властивості йодат-іонів
У пробірку налити 5—7 крапель розчину йодиду калію і 2—З краплі сірчаної кислоти. Розчин збовтати і додавати краплями розчин йодату калію до появи темно-бурого кольору йоду, наявність якого можна підтвердити внесенням 1—2 крапель розчину крохмалю. Скласти рівняння реакції йодиду калію з йодатом калію з утворенням вільного йоду. Дати окисно-відновну характеристику йодатам.
Дослід 9. Відновні властивості йоду
До 2—3 крапель йодної води додати 1 краплю розчину крохмалю і 2— З краплі свіжої хлорної води. Чи зникає синє забарвлення розчину? Написати рівняння реакції. Які властивості проявляють у даній реакції хлор та йод?
Дослід 10. Реакції виявлення йодид-іонів
A. У пробірку налити З—4 краплі розчину йодиду калію або натрію і додати 1—2 краплі розчину нітрату срібла. Визначити колір і структуру осаду йодиду срібла. Скласти рівняння у молекулярному та іонному вигляді. Одержаний осад розділити на дві пробірки і в одну з них додати 1 — 2 краплі розчину азотної кислоти, в другу — розчин аміаку. Зробити висновок про відношення йодиду срібла до азотної кислоти та аміаку.
Б. Налити у пробірку 2—З краплі розчину йодиду калію або натрію і додати таку саму кількість розчину нітрату свинцю. Спостерігати утворення РЬЬ яскраво-жовтого кольору. Далі додати у пробірку 8—10 крапель дистильованої води і декілька крапель оцтової кислоти та підігріти до розчинення осаду. Поступово розчин охолоджувати і спостерігати появу осаду РbІ2 у крупнокристалічній формі (блискучі золотисто-жовті лусочки).
В. Налити у пробірку 2—З краплі розчину йодиду калію або натрію і додати стільки ж крапель нітрату ртуті (II). Спостерігати утворення червоного осаду йодиду ртуті. При подальшому додаванні йодид-іонів осад розчиняється з утворенням комплексної сполуки — тетрайодомеркурат-іонів:
Hgl2+2І- → [Hgl4]2-.
Скласти рівняння реакції з урахуванням стадій їх здійснення.
Питання для самоконтролю
1. Виходячи з положення йоду в періодичній системі і будови атома, дати характеристику його окисним і відновним властивостям. Вказати найголовніші валентні стани й ступені окиснення.
2. Як можна пояснити, ш, о для йоду більш характерні непарні ступені окиснення, ніж парні?
3. Розповсюдженість йоду в природі, його біологічна роль.
4. Яка розчинність йоду у воді, спирті та інших органічних розчинниках? Чим пояснюється підвищена розчинність йоду у розчинах йодиду калію?
5. Чому йодоводнева кислота менш стійка, ніж інші галогеноводневі кислоти?
6. Закінчити рівняння реакцій. Скласти електронний баланс і підібрати коефіцієнти. Вказати елемент-окисник та елемент-відновник:
І2 +СІ2 + Н2О →
І2 + HNO3 конц. →
Рb02 + КІ + H2SO4 →
FeCl3 + НІ →
7. Яку роль виконує йод у сільському господарстві?
Лабораторна робота №9
НЕПЕРЕХІДНІ БЮМЕТАЛИ 1-ї ГРУПИ ПЕРІОДИЧНОЇ СИСТЕМИ. НАТРІЙ. КАЛІЙ.
Мета роботи; поглиблення теоретичних знань про натрій і калій як неперехідні біометали 1-ї групи періодичної системи, вивчення окисно- відновних властивостей сполук натрію і калію та якісних реакцій на катіони Na+, К+.
Дослід 1. Забарвлення полум 'я сполуками натрію та калію
Для дослідів використовують розчини хлоридів натрію та калію.
У полум’ї газового пальника або спиртівки декілька разів прожарити залізний дріт, а потім змочити його розчином хлориду калію і внести у полум'я. Спостерігати фіолетове забарвлення.
Дріт промити у соляній кислоті, добре прожарити і далі змочити розчином хлориду натрію і внести у полум'я. Спостерігати жовте забарвлення.
Дослід 2. Взаємодія пероксиду натрію з водою У суху пробірку внести 1 мікрошпатель пероксиду натрію і додати 4—5 крапель води. Розчин підігріти і внести у пробірку тліючу скіпку. Який газ при цьому виділяється? Після закінчення реакції до розчину додати 1—-2 краплі фенолфталеїну. У який колір забарвлюється розчин у пробірці? Скласти рівняння реакції пероксиду натрію з водою.
Дослід 3. Відновні властивості пероксиду натрію
А. У пробірку налити З—5 крапель розчину перманганату калію, підкислити 2—З краплями 2 н. сірчаної кислоти і додати мікрошпатель пероксиду натрію. Суміш перемішати. Як змінюється забарвлення розчину? Скласти рівняння реакції.
Б. У пробірку внести 5—7 крапель 0, 1 н. розчину перманганату калію і один мікрошпатель пероксиду натрію. Суміш перемішати. Спостерігати виділення газу та утворення бурого осаду. Скласти рівняння реакції.
Дослід 4. Окисні властивості пероксиду натрію
У пробірку внести 1—2 краплі розчину йодиду калію і таку саму кількість 2 н. сірчаної кислоти; додати мікрошпатель пероксиду натрію і 5—7 крапель дистильованої води. Для виявлення вільного йоду додати до суміші 1 краплю розчину крохмалю. Написати рівняння реакції.
Дослід 5. Гідроліз солей натрію та калію
На червоний лакмусовий папірець нанести по одній краплі розчинів: карбонатів натрію і калію, сульфатів натрію і калію, ацетату натрію, сульфіту та хлориду калію. У кожному випадку визначити реакцію середовища і встановити солі, що підлягають гідролізу. Написати рівняння реакцій гідролізу солей у молекулярній та іонній формах.
Дослід 6. Якісна реакція на катіони натрію Na+.
У пробірку з 2—З краплями розчину солі натрію додати таку саму кількість розчину гексагідроксостибіату (V) калію — К[Sb(ОН)6]. Реакцію проводити при охолодженні розчину водою з під крану і потиранні внутрішніх стінок пробірки скляною паличкою. Спостерігати утворення білого дрібнокристалічного осаду. Скласти рівняння реакції в молекулярній та іонній формах.
Дослід 7. Якісні реакції на катіон калію K+.
А. До 3—4 крапель розчину солі калію додати таку саму кількість розчину гідротартрату натрію (виннокислий натрій) NaHC4H406. Потерти скляною паличкою по внутрішніх стінках пробірки і охолодити пробірку під
краном. Спостерігати за утворенням білого дрібнокристалічного осаду гідротартрату калію.
Б. До 3—4 крапель розчину солі калію додати З краплі розчину комплексної солі гексанітрокобальтату (III) натрію Na3[Co(N02)6] і спостерігати за утворенням жовтого кристалічного осаду гексанітрокобальтату калію — натрію (2: 1) K2Na[Co(N02)6]. Скласти рівняння реакції в молекулярній та іонній формах.
Питання для самоконтролю
1. Скласти електронні формули атомів натрію та калію. Користуючись електронними формулами та періодичною таблицею, пояснити;
а) за якою ознакою можна робити висновки про аналогію їх хімічних властивостей;
б) чому їх відносять до найбільш активних металів;
в) чому відновна здатність підвищується від натрію до калію;
г) яка їх взаємодія з водою, киснем, кислотами?
2. Що відбувається з гідроксидами натрію і калію, якщо їх зберігати у відкритих посудинах? На що вони поступово перетворюються?
3. Запропонувати можливі способи переходів за наступними схемами:
Na → Na2О2→ Na20→ NaOH→ NaHS04→ Na2S04→ Na→ KCl→ К→ КОН→ K2СО3→ КНСОз→ KCI
4. Яку реакцію середовища мають розчини солей:
а) KNO3;
б) K2S;
в) СНзСООК?
Напишіть рівняння гідролізу для тих випадків, де він має місце.
5. Наведені схеми заповнити таким чином, щоб одержати рівняння реакцій, що відбуваються до кінця:
а) NaOH +.... → NaCl +....
б) Na2C03 + …. → NaCl +....
в) Na2SО4 +....→ NaNO3+….
г) Рb(NО3)2 + …. → NaN03+....
6. Охарактеризувати роль натрію, що міститься в організмах тварин і людини. Що таке «натрієвий насос»?
7. Яку біологічну роль виконує калій в рослинних і тваринних організмах?
Лабораторна робота №10
НЕПЕРЕХІДНІ БІОМЕТАЛИ ІІ-Ї ГРУПИ ПЕРІОДИЧНОЇ СИСТЕМИ. МАГНІЙ. КАЛЬЦІЙ.
Мета роботи: вивчити деякі властивості магнію і кальцію, їх якісні реакції.
Дослід1. Взаємодія магнію з водою
Налити у дві пробірки по 1—2 см3 дистильованої води і додати порошку (або шматочки) магнію. Чи реагує магній з холодною водою?
Нагріти одну з пробірок до кипіння води і спостерігати за розкладанням магнію водою.
У другу пробірку додати трохи концентрованого розчину хлориду амонію і підігріти. Спостерігати бурхливу реакцію виділення водню. Чому нагрівання і наявність хлориду амонію прискорюють розкладання води магнієм? Скласти рівняння реакцій.
Дослід 2. Одержання і властивості гідроксиду магнію
Налити у пробірку З—5 крапель розчину солі магнію (сульфат, хлорид або нітрат) і додати такий самий об'єм розведеного розчину гідроксиду натрію або калію. Спостерігати за утворенням білого драглистого осаду. В окремих пробірках подіяти на осад надлишком лугу і розведеними кислотами (НСІ або HNO3). Що при цьому спостерігається? Написати рівняння реакцій.
Дослід 3. Вплив солей амонію на розчинність гідроксиду магнію.
Налити у дві пробірки по З—5 крапель солі магнію, додати в одну з них такий самий об’єм концентрованого розчину хлориду амонію, а далі краплями доливати в обидві пробірки розчин аміаку. Спостерігати в одній з пробірок утворення осаду гідроксиду магнію. Додати у цю пробірку
концентрованого розчину хлориду амонію і спостерігати за розчиненням осаду. Пояснити з точки зору хімічної рівноваги в системі:
Mg(0H)2 + 2NH4CI → MgCI2 + 2NH4OH,
чому за наявності надлишку солі амонію не випадає осад гідроксиду магнію, а утворений осад гідроксиду розчиняється.
Дослід 4. Реакція виявлення катіонів магнію
До 4—5 крапель розчину солі магнію долити розчин аміаку. Спостерігати за утворенням осаду. Далі додавати краплями розчин хлориду амонію до повного розчинення осаду, а потім до прозорого розчину суміші долити 2—З краплі гідроортофосфату натрію. Спостерігати за випаданням білого кристалічного осаду ортофосфату магнію — амонію MgNH4P04. Написати молекулярне та іонне рівняння реакції.
Дослід 5. Забарвлення полум 'я сполуками кальцію
У полум’ї декілька разів прожарити залізний дріт. Змочити його розчином хлориду кальцію і внести у безбарвну частину полум'я газового пальника. Спостерігати за тим як полум'я набуває червоного кольору.
Дослід 6. Одержання карбонату кальцію
Налити у пробірку 3—4 краплі розчину хлориду кальцію і додати таку саму кількість розчину карбонату натрію. Спостерігати за утворенням білого осаду карбонату кальцію. Скласти рівняння реакції у молекулярній та іонній формах.
Дослід 7. Якісна реакція на, катіони кальцію
До 2—3 крапель розчину солі кальцію додати таку саму кількість розчину оксалату амонію (NH)4C204 (сіль щавлевої кислоти). Спостерігати за утворенням білого осаду. Нагрівання сприяє швидкому осадженню оксалату кальцію.
Скласти рівняння реакції у молекулярній та іонній формах.
Питання для самоконтролю
1. Дати коротку характеристику магнію та кальцію. Вказати будову їх атомів, хімічну активність, взаємодію з водою та кислотами.
2. Пояснити, чому магній дуже повільно взаємодіє з водою при кімнатній температурі, а при нагріванні реакція прискорюється; чому магній розчиняється у водному розчині хлориду амонію.
3. Закінчити рівняння реакцій. Скласти електронний баланс, вказати окиснювач та відновник:
СаН3 + Н2О →
СаН2 + О2 →
4. Чому гашене вапно при тривалому зберіганні втрачає свої властивості?
5. Які солі магнію та кальцію зумовлюють твердість природної води? Навести способи обробки води методом реагентного пом’якшення і методом іонного обміну.
6. Які солі магнію і кальцію знайшли застосування у галузях промисловості?
7. Вказати біологічну роль кальцію і магнію.
Лабораторна робота №11
ПЕХЕХІДНІ БІОМЕТАЛИ. МАРГАНЕЦЬ. ЗАЛІЗО
Мета роботи: навчитися синтезувати гідроксид марганцю (II), гідроксид заліза (II), гідроксид заліза (ІІІ), вивчити деякі їх властивості, а також якісні реакції на іони Mn2+, Fe2+, Fe3+.
Дослід 1. Одержання і властивості гідроксиду марганцю
Налити у пробірку 10-15 крапель розчину сульфату марганцю і додати такий самий об’єм розчину гідроксиду натрію. Спостерігати за утворенням білуватого осаду гідроксиду марганцю (II).
Розділити одержаний осад на три пробірки. Долити в одну з них розведену сірчану або хлоридну кислоту, а в другу - надлишок лугу. Пояснити, чому осад у кислоті розчиняється, а в розчині лугу - нерозчиняється.
Вміст третьої пробірки кілька разів збовтати і залишити на деякий час. Спостерігати поступову зміну забарвлення осаду внаслідок окиснення киснем повітря марганцю (II) до марганцю (IV).
Написати рівняння реакцій, що відбулися.
Дослід 2. Рівновага в системі Мп(ОН)2+ NH4CI
У дві пробірки налити по 5-6 крапель розчину сульфату марганцю. В одну з них додати такий самий об’єм 10%-го розчину NH4CI і в кожну з пробірок прилити по 4-5 крапель розчину аміаку. Пояснити, чому в розчині, що містить NH4CI, не утворився осад. У пробірку з осадом додавати краплями розчин хлориду амонію і спостерігати за поступовим розчиненням осаду.
Дослід З. Одержання малорозчинних солей марганцю (II)
У три пробірки налити по 3-4 краплі розчину сульфату марганцю (II) і додати в кожну однаковий об'єм хромату калію, карбонату натрію і сульфіду амонію. Відзначити кольори осадів. Додати до кожного осаду по 3-4 краплі розчину кислоти (HC1, HN03, H2SO4). Зробити висновки про розчинність одержаних солей марганцю у кислому середовищі. Скласти рівняння реакцій.
Дослід 4. Відновлення марганцю (VІI) марганцем (II)
Налити у пробірку 5 крапель розчину сульфату марганцю (II) і додати краплями розчин перманганату калію. Спостерігати за знебарвленням малинового кольору розчину і утворенням бурого осаду. Дослідити вміст пробірки синім лакмусовим папірцем. Написати рівняння реакцій.
Дослід 5. Якісні реакції на катіони Мп2+
А. Окиснення Мn2+ оксидом свинцю (IV).
Взяти у пробірку крихту оксиду свинцю (IV) - Рb02, прилити 4-5 крапель концентрованої азотної кислоти і додати 1 краплю (не більше!) розчину сульфату або нітрату (тільки не хлориду) марганцю (II). Суміш перемішати і нагріти на водяній бані до 80°С. Спостерігати малинове забарвлення розчину за рахунок іонів Мn04-. Скласти рівняння реакції, що відбувається. При подальшому поступовому додаванні малинове забарвлення зникає, оскільки МnО4- відновлюється іонами Мn2+ (дослід 4).
Б. Окиснення Мn2+ персульфатом амонію (NH4)2S208. Помістити у пробірку 5-6 крапель дистильованої води, 1 краплю солі Мn2+, 2-3 краплі НNО3, 1-2 краплі 0, 1 н. розчину AgN03 (каталізатор) і додати 2-3 кристалики персульфату амонію або 5-6 крапель його 50%-го розчину. Суміш нагріти на водяній бані до 80  С і спостерігати появу малинового забарвлення розчину. Скласти рівняння відповідної реакції. У разі відсутності каталізатора окиснення Мn2+ відбувається до МnО2 (бурий осад).
С і спостерігати появу малинового забарвлення розчину. Скласти рівняння відповідної реакції. У разі відсутності каталізатора окиснення Мn2+ відбувається до МnО2 (бурий осад).
Дослід 6. Взаємодія заліза з розведеними кислотами.
У три пробірки внести по 4-5 крапель 2 н. розчинів соляної, сірчаної та азотної кислот. У кожну пробірку додати по шматочку залізної стружки. Якщо реакція відбувається повільно, пробірку підігріти на водяній бані. Далі в кожну пробірку додати по 1 краплі 0, 01 н. розчину тіоціанату калію або амонію, які з іонами дають червоне забарвлення. Написати рівняння відповідних реакцій.
Дослід 7. Одержання гідроксиду заліза (II) та дослідження його властивостей
У три пробірки внести по 3-5 крапель розчину сульфату заліза (II) або солі Мора і додати по 2-3 краплі 2 н. розчину гідроксиду калію (натрію). Зафіксувати колір осаду, що утворився. Одну пробірку залишити і спостерігати за зміною кольору осаду з часом. У дві інші пробірки додати: у першу - надлишок лугу, у другу - розчин сірчаної кислоти. Який висновок можна зробити про хімічні властивості гідроксиду заліза (II)? Написати всі необхідні реакції.
Дослід 8. Одержання гідроксиду заліза (III) та дослідлсення його властивостей
У дві пробірки внести по 2-3 краплі розчину солі заліза (III) і додати в кожну пробірку по 1-2 краплі 2 н. розчину гідроксиду калію (натрію). Відзначити колір осадів, що утворилися. В одну пробірку внести 2-3 краплі хлористоводневої кислоти, у другу – 2-3 краплі гідроксиду калію. В якій пробірці відбувається розчинення осаду? Скласти відповідні рівняння реакцій.
Дослід 9. Гідроліз солей заліза
А. Гідроліз сульфату заліза (II). У пробірку внести 1 мікрошпатель
FeS04 • 7Н2О і 3-5 крапель води. За допомогою універсального індикатора визначити реакцію середовища. Написати рівняння реакції гідролізу FeS04 в молекулярному та іонному вигляді.
Б. Гідроліз хлориду заліза (III). У дві пробірки внести по одному мікрошпателю заліза (III) і по 3-5 крапель води. За допомогою універсального індикатора визначити реакцію середовища. Далі одну з пробірок підігріти. Чи змінився рН розчину? Написати рівняння реакцій гідролізу FеСІ3 в молекулярному та іонному вигляді при кімнатній температурі та при нагріванні.
Дослід 10. Якісні реакції на іони Fe2+ і Fe3+
A. Дія на солі заліза (II) гексаціаноферату (III) калію. У пробірку внести 2-3 краплі солі заліза і додати 1-2 краплі розчину гексаціаноферату (III) калію. Відзначити колір осаду, що утворився (турнбулева синь). Написати рівняння реакції в молекулярному та іонному вигляді.
Б. Дія на солі заліза (ІII) гексаціаноферату (II) калію. У пробірку внести 2-3 краплі розчину хлориду заліза (III) і додати 1 краплю розчину гексаціаноферату (II) калію. Відзначити колір осаду, що утворився (берлінська лазур). Написати рівняння реакції в молекулярному та іонному вигляді.
B. Дія на солі заліза (III) тіоціанату амонію (або калію). У пробірку взяти 2-3 краплі розчину хлориду заліза (III) і додати 1-2 краплі тіоціанату амонію (калію). Чим зумовлено забарвлення розчину у червоний колір? Написати рівняння реакції.
Дослід 11. Відновні властивості солей заліза (II)
У дві пробірки налити по 3-5 крапель свіжоприготовленого розчину сульфату заліза (II) або сульфату амонію - заліза (II), підкислити 2-3
краплями розведеної сірчаної кислоти. У першу пробірку долити хлорної води, у другу - додавати краплями розчин КМnО4. Що при цьому спостерігається? За допомогою розчину тіоціанату амонію (калію) встановити наявність у кожній пробірці Fe3+. Написати рівняння реакцій і скласти до них електронний баланс.
Дослід 12. Окисні властивості сполук заліза (III)
У дві пробірки налити по 3-4 краплі розчину FеСІ3 - В одну з них додати розчин йодиду калію і кілька крапель розчину крохмалю. Що при цьому спостерігається?
У другу пробірку додати 3-5 крапель прозорого розчину сірководневої води і спостерігати за помутнінням розчину внаслідок виділення сірки.
За допомогою гексаціаноферату (III) калію встановити наявність у розчині іонів Fe2+. Написати реакції і скласти до них електронний баланс.
Дослід 13. Одержання сполук заліза (VI)
Помістити у пробірку пінцетом декілька шматочків подрібненого КОН, додати 1 краплю насиченого розчину FеСI3 і (під тягою!) 2 краплі брому. Після слабкого нагрівання утворюється фіолетовий розчин ферату калію К2FeО4. В окрему пробірку взяти половину розчину, що утворився, і додати 3-4 краплі розчину хлориду барію. Спостерігати випадання осаду ферату барію. Скласти рівняння реакції окиснення заліза (III) бромом у лужному середовищі та утворення малорозчинного ферату барію.
Питання для самоконтролю
1. Навести коротку характеристику марганцю. Виходячи з будови атома марганцю, показати його можливі валентні стани та ступені окиснення.
2. Чим пояснити, що при великій різниці властивостей сполук марганцю і хлору з нижчими валентними станами сполуки цих самих елементів з вищими валентними станами мають схожість?
3. Порівняти іони, які утворює марганець з різними валентними станами, за їх схильністю до участі у таких хімічних перетвореннях у водному розчині: гідроліз; відновлення у кислому середовищі; окиснення у лужному середовищі; диспропорціювання; перехід у лужному середовищі катіонів у аніонну форму.
4. Скласти електронні формули іонів Мn2+, Мn4+, Mn7+. На основі будови іонів пояснити їх окисно-відновні властивості.
5. Які з реакцій можуть бути використані для одержання МпОг
1) Мn + 02 → 5)МnСI2 + Н20 →
2) МnО + 02 → 6) Мn(0Н)2 + СI2 + КОН →
3) Мn2О7 → 7) Мn + HNО3 →
4) МnО + КСIO3 → 8) КМnО4 + Н2О2 + Н2О →
6. Написати рівняння реакцій, що відбуваються при сплавленні суміші діоксиду марганцю, бертолетової солі і лугу; при внесенні металічного цинку у розчин, що містить хлорид марганцю та ціанід калію.
7. Скласти рівняння реакцій, у яких сполука марганцю (IV) виявляє відновні та окисні властивості.
8. Написати електронну формулу атома заліза. Визначити його валентні властивості. Навести приклади сполук, у яких залізо виявляє різні валентності.
9. Як з металічного заліза одержати сульфат заліза (II) і сульфат заліза (III)?
10. Написати молекулярні та іонні рівняння гідролізу таких солей: FeS04, FеСІз, Fе(СНзСОО)з. Яке середовище буде у розчині кожної солі?
11. Написати формули двох солей заліза (ІІІ), в одній з яких залізо є катіоном, а в іншій – входить до складу аніона.
Лабораторна робота №12
ПЕРЕХІДНІ БІОМЕТАЛИ. КОБАЛЬТ. МІДЬ
Мета роботи: практично одержати гідроксид кобальту (II), гідроксид кобальту (III), гідроксид міді (II), вивчити їх властивості, якісну реакцію на іон Со2+.
Дослід 1. Одержання і властивості гідроксиду кобальту (ІІ)
Внести у пробірку 3-5 крапель розчину солі кобальту (II) і додати краплями такий самий об'єм гідроксиду натрію. Спостерігати за утворенням осаду основної солі синього кольору, яка при додаванні надлишку лугу перетворюється у рожевий гідроксид кобальту (реакція прискорюється нагріванням).
Осад з рідиною розділити на дві пробірки. В одну з них додати розведеної хлоридної, сірчаної або азотної кислоти і спостерігати за розчиненням осаду, а другу залишити на деякий час на повітрі. Звернути увагу на поступове побуріння осаду внаслідок окиснення гідроксиду кобальту (II). Написати рівняння реакцій.
Дослід 2. Одержання і властивості гідроксиду кобальту (III)
Налити у дві пробірки по 3-5 крапель розчину солі кобальту (II). Додати в одну з них 2-3 краплі бромної або хлорної води (під тягою!), у другу - пероксиду водню, а потім в обидві пробірки долити по 3-5 крапель розчину лугу. Спостерігати за утворенням чорного осаду гідроксиду кобальту (III).
У кожну пробірку до осаду додати 2-3 краплі концентрованої хлоридної кислоти. Спостерігати за розчиненням осаду. Звернути увагу на колір і запах газу, ш, о виділяється. Дослідити газ змоченим водою йодкрохмальним папірцем. Написати рівняння реакцій.
Дослід 3. Аміакати кобальту (ІІ) і кобальту (ІІІ)
У дві пробірки внести по 2-3 краплі розчину солі кобальту (II) і декілька крапель концентрованого розчину аміаку до розчинення осаду основної солі. Розчин в одній пробірці перемішати скляною паличкою, а в другу - додати 2-3 краплі розчину пероксиду водню. Відзначити зміну забарвлення розчинів. Написати рівняння реакцій одержання та окиснення аміачних комплексів кобальту.
Дослід 4. Якісна реакція на іони Со2+
До 2-3 крапель розчину солі кобальту (II) долити 5-8 крапель насиченого розчину тіоціанату амонію або калію і додати 5-6 крапель амілового спирту. Спостерігати за забарвленням верхнього шару рідини у синій колір внаслідок утворення комплексної солі з аніоном [Co(NCS)2-], яка в органічних розчинниках розчиняється краще, ніж у воді.
Дослід 5. Взаємодія оксиду міді (ІІ) з кислотами
У дві пробірки внести по 1-2 мікрошпателя оксиду міді (II) і долити 5-6 крапель 2 н. кислот: в одну пробірку - соляної, у другу - сірчаної. Підігріти на водяній бані і спостерігати забарвлення розчинів у пробірках. Написати рівняння реакцій.
Дослід 6. Одержання гідроксиду міді (ІІ) та його термічна стійкість
У пробірку внести 2-3 краплі розчину солі міді (II) і додати 2-3 краплі розчину гідроксиду калію (натрію). Нагріти пробірку з осадом, що утворився. Відзначити зміну кольору осаду внаслідок розкладання гідроксиду міді (II). Написати рівняння реакцій.
Дослід 7. Відношення гідроксиду міді (ІІ) до кислот і лугів
У трьох пробірках одержати гідроксид міді (II) (див. дослід 6) і додати: першу надлишок концентрованого розчину гідроксиду калію (натрію), у
другу - 2 н. розчин гідроксиду калію (натрію), у третю - 2 н. розчин сірчаної кислоти. Де відбувається розчинення осаду? Написати рівняння реакцій.
Дослід 8. Одержання сульфіду міді (II)
У пробірку внести 3-4 краплі розчину сульфату або хлориду міді (ІІ) і додати таку саму кількість крапель сірководневої води. Відзначити колір осаду сульфіду міді (II). Перевірити розчинність CuS у концентрованій азотній кислоті. Написати рівняння реакцій.
Дослід 9. Гідроліз солей міді (II)
У дві пробірки внести по 2-3 краплі 0, 5 н. розчину сульфату (або хлориду) міді (II) і за допомогою універсального індикатора визначити реакцію середовища. В одну пробірку додати 2-3 краплі гарячого розчину карбонату натрію. Спостерігати утворення зеленого осаду гідроксокарбонату міді і виділення газу. Написати рівняння реакцій гідролізу солі міді в молекулярному та іонному вигляді. Чому додавання карбонат-іона посилює гідроліз солі міді (II)?
Дослід 10. Одержання йодиду міді (І)
У пробірку внести по 3-4 краплі розчинів сульфату міді (II) і йодиду калію. Спостерігати утворення осаду і забарвлення розчину в пробірці у жовтий колір. Чим зумовлено забарвлення? Додати у пробірку декілька крапель розчину сульфіту натрію до зникнення жовтого забарвлення. Написати рівняння реакцій.
Дослід 11. Одержання гідроксиду міді (І) і його розклад
Внести у пробірку 2-3 краплі розчину хлориду міді (II), додати 5-6 крапель 10%-го розчину формальдегіду НСНО і суміш нагріти до кипіння. Додати 4-5 крапель розчину гідроксиду натрію. При подальшому нагріванні суміші спостерігати утворення червоного осаду оксиду міді (І). Написати
рівняння реакцій одержання гідроксиду міді (І) і його розкладу при нагріванні.
Дослід 12. Одержання аміачного комплексу міді (ІІ)
У пробірку з розчином сульфату міді (II) (3-4 краплі) додавати краплями 20% -й розчин аміаку до повного розчинення осаду основної солі (СuOН)2S04. Відмітити забарвлення аміачного комплексу міді (II). Написати рівняння реакцій одержання основної солі та її взаємодію з розчином аміаку.
Питання для самоконтролю
1. Скласти електронні формули атома кобальту, іонів Со2+ та Со3+. Зробити прогноз їх хімічних властивостей.
2. Скласти рівняння реакцій, за якими можливі наступні
перетворення:
CoS → СоО → Со(НОз)2 → [Co(SCN)4].
3. Скласти рівняння окисно-відновних реакцій та електронний баланс до них. Визначити окиснювач та відновник:
СоСІ2 + NНз + NH4CI + Н2О2 →
СоВг2 + О2 + КОН + Н2О →
CoSO4 + К2S2O8 + КОН →
Co(CN)2 + KCN + Н2О2 →
4. У чому виявляється схожість кобальту і заліза (на прикладі відношення до концентрованої азотної кислоти, стійкість гідроксидів (II) на повітрі)?
5. Чим відрізняються Сo2О3 і Со(ОН)3 від Fе203 і Fе(ОН)3?
6. Закінчити рівняння реакцій:
СО3О4 + Н2S04 →
Со(ОН)3 + НСI →
7. Як мідь взаємодіє з водою, киснем повітря, кислотами, лугами? Написати рівняння відповідних реакцій.
8. Як взаємодіє гідроксид міді (II) з надлишком розчинів гідроксиду натрію і з водним розчином аміаку? Написати рівняння реакції.
9. Гідроксид міді (II) розчиняється у розведених кислотах та в розчині аміаку. Чи однотипні реакції, що при цьому відбуваються? Написати в молекулярному та іонному вигляді відповідні рівняння реакцій.
10. Скласти рівняння реакцій до наступних перетворень:
Сu → СuО → CuS04 → Сu(0Н)2 → СuО → Сu(НО3)2.
11. Який осад утворюється при взаємодії розчинів CuSO4 і Nа2СО3? Написати рівняння реакцій в молекулярній та іонній формах.
12. Як наявність мідь проявляється у метаболізмі рослин? Яка роль міді в організмах тварин і людини?
13. Дати характеристику біологічній ролі кобальту.
Лабораторна робота № 13
ПЕРЕХІДНІ БІОМЕТАЛИ. ЦИНК. МОЛІБДЕН
Мета роботи: синтезувати гідроксид цинку і вивчити його властивості, а також властивості сполук молібдену.
|
|
