
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Окислительно-восстановительные процессы в почвах
|
|
1. Окислительно-восстановительные реакции (основные понятия и определения)
К окислительно-восстановительным реакциям относят химические реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется (Морозов и др., 2003).
Степень окисления – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице (частица состоит из ионизированных атомов).Величина степени окисления выражается в количестве отданных (принятых) электронов (Морозов и др., 2003).
Окислительно-восстановительные процессы осуществляются за счет перераспределения электронной плотности или полного перехода электронов между атомами реагентов (Павлов, 2002).
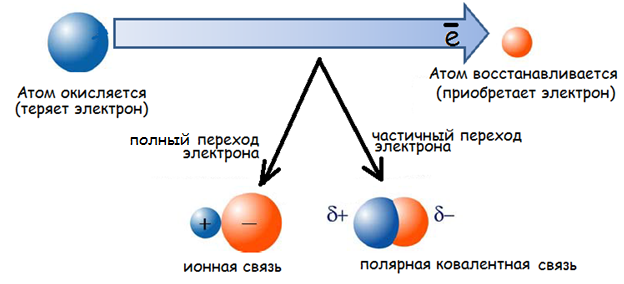
Процесс передачи электронов называется окислением. Процесс присоединения электронов называется восстановлением.
Вещества, атомы которых в ходе реакции присоединяют электроны –восстанавливаются и называются окислителями (Ox – oxidant). Вещества, атомы которых отдают электроны – окисляются и называются восстановителями (Red - reductant).
Окислительно-восстановительная реакция включает в себя две противоположно-направленных реакции – окисления и восстановления. В такой реакции всегда принимают участие две пары конкурирующих за электроны сопряженных окислителей и восстановителей (редокс-пары).
Окислительно-восстановительная реакция может быть записана в виде двух полуреакций:
Ox1+ ne = Red1 (полуреакция восстановления)
и
Red2– ne= Ox2 (полуреация окисления).
Суммарная окислительно-восстановительная реакция записывается следующим образом:
Ox1+ Red2= Red1+ Ox2
Изменение энергии Гиббса для полуреакции восстановления реакции описывается уравнением:
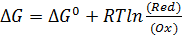 , где
, где
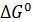 – величина, при которой активности ионов равны 1.
– величина, при которой активности ионов равны 1.
|
|