
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача 4 (автор Медведев Ю. Н.).
|
|
1. Малорастворимы сульфат, тиосульфат и сульфит бария, причем сульфит и тиосульфат бария растворяется лишь при значительном подкислении (рН < 2). Тогда осадки сульфата бария могут образоваться при сливании растворов:
KHSO4 + Ba(NO3)2 = BaSO4¯ + KNO3 + HNO3
K2S2O7 + H2O + 2Ba(NO3)2 = 2BaSO4¯ + 2KNO3 + 2HNO3
K2S2O3 + BaCl2 = BaS2O3↓ + 2KCl
Т. к. при растворении в воде происходит быстрая реакция гидролиза пиросульфат-иона:
K2S2O7 + H2O = 2KHSO4
Сульфит бария будет выпадать из растворов среднего сульфита калия и метабисульфита (кислого сульфита) калия:
K2SO3 + Ba(NO3)2 = BaSO3¯ + 2KNO3
K2S2O5 + Ba(NO3)2 + (H2O) = BaSO3¯ + 2KNO3 + SO2 + (H2O)
После продолжительного стояния осадки сульфата бария будут образовываться и из раствора персульфата (пероксодисульфата) калия и пероксосульфата (соли кислоты Каро):
K2S2O8 + 2H2O = 2KHSO4 + H2O2
K2SO5 + H2O = K2SO4 + H2O2
При стоянии на воздухе дитионит, сульфит и метабисульфит будут окисляться на воздухе:
2K2S2O4 + 3O2 + 2H2O → 4KHSO4
2K2SO3 + O2 → 2K2SO4
K2S2O5 + O2 +H2O → 2KHSO4
2. Кислые соли (KHSO4, K2S2O7, K2S2O5) будут иметь кислую среду:
HSO4– + H2O ⇄ SO42– + H3O+
При растворении в воде пиросульфат превращается в гидросульфат и дает такую же кислотность раствора:
S2O72– + H2O ⇄ 2HSO4–
Для оценки рН растворов можно использовать оценочное значение констант диссоциации соответствующих кислот. Напомним, что согласно правилам Полинга, сила кислоты зависит от числа концевых атомов кислорода. При отсутствии концевых атомов кислорода кислота будет слабой и иметь константу примерно равную 10–7, например, хлорноватистая кислота. С увеличением числа концевых атомов кислорода на единицу сила кислоты возрастает на пять порядков:
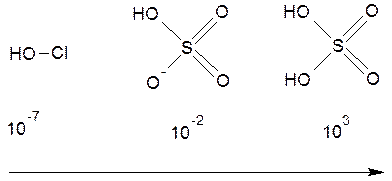
Kдисс возрастает, сила кислот возрастает
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Заметим, что в гидросульфат-ионе содержится два концевых атома кислорода, но электронный эффект одного из них компенсирован атомом кислорода, несущим отрицательный заряд.
Так, константа диссоциации серной кислоты по второй стадии составит 10–2: HSO4– – одноосновная кислота с одним концевым атомом кислорода. Для определения концентрации ионов водорода запишем выражение для константы, где [ H +] = x,
[ HSO 4–] = 0, 1 – x:
KII = [ H +]2/[ HSO 4–] = x 2/(0, 1 – x) = 10–2
x = 0, 027
Полученный при растворении гидросульфата раствор будет иметь рН = –lg 0, 027 = 1, 57. Раствор, полученный растворением пиросульфата калия (2 M KHSO4), будет иметь меньшее значение рН: рН = –lg 0, 04 = 1, 4.
Соли, образованные слабыми кислотами (сернистой кислотой по второй стадии, кислота Каро по второй стадии, тиосерной по второй стадии) будут иметь щелочную среду раствора:
SO32– + H2O ⇄ HSO3– + OH–
SO52– + H2O ⇄ SO5H– + OH–
S2O32– + H2O ⇄ HS2O3– + OH–
В обоих случаях оценочное значение второй константы диссоциации составляет 10–7.
Kгидр = 10–14/10–7 = [OH]2/[HA] = 10–7; [OH] = 10–4; pOH = 4
pH = 14 – pOH = 10
В растворе метабисульфита в равновесии находятся ионы:
S2O52– + H2O ⇄ 2HSO3–
(по своему составу ион HSO3– – одноосновная кислота без концевых атомов кислорода – слабая кислота с рК» 7). Полученный раствор может иметь слабокислую среду (рН» 3, 85).
При длительном стоянии водных растворов K2S2O8, K2SO5 протекает полный гидролиз аниона:
K2S2O8 + 2H2O = 2KHSO4 + H2O2
(рН такого раствора, как и в случае K2S2O7, будет несколько меньше 2).
K2SO5 + H2O = K2SO4 + H2O2
(Получается нейтральный раствор).
Как было сказано выше, при стоянии на воздухе растворы дитионита, сульфита и метабисульфита калия окисляются кислородом воздуха:
2K2S2O4 + 3O2 + 2H2O → 4KHSO4 (рН раствора меньше 2)
2K2SO3 + O2 = 2K2SO4 (нейтральный раствор)
K2S2O5 + H2O + O2 = 2KHSO4 (рН раствора меньше 2).
3. Соединения со связью S – S:
K2S2O3, K2S2O4, K2S2O5, K2S2O6, K2S4O6.
Соединения со связью O – O:
K2SO5, K2S2O8.
4. Окислителями в реакции с иоидид-ионом будут растворы персульфат-иона (до гидролиза и после гидролиза) и соль кислоты Каро:
S2O82– +2I– = 2SO42– + I2 (до гидролиза)
H2O2 + 2I– + 2H+ = I2 + 2H2O (после гидролиза)
SO52– + 2I– + 2H+ = SO42– + I2 + H2O
Восстановителями в реакциях с перманганат-ионом будут низшие соединения серы: сульфит, метабисульфит, дитионит, тиосульфат, дитионат, тетратионат и пероксид водорода, образующийся при гидролизе персульфат-иона и соли кислоты Каро:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
5SO32– + 2MnO4– + 6H+ = 5SO42– +2Mn2+ + 3H2O
5S2O42– + 6MnO4– + 8H+ = 10SO42– + 6Mn2+ + 4H2O
5S2O52– + 4MnO4– + 2H+ = 10SO42– + 4Mn2+ + H2O
2MnO4– + 5H2O2 + 6H+ = 2Mn2+ + 5O2 + 8H2O
5S2O32– + 8MnO4– + 14H+ = 10SO42– + 8Mn2+ + 7H2O
5S2O62– + 2MnO4– + 2H2O = 10SO42– + 2Mn2+ + 4H+
5S4O62–+ 2MnO4– + 2H2O = 10SO42– + 10S + 2Mn2+
Система оценивания.
1. а) по 0, 5 б. за 5 веществ, всего 2, 5 балла.
б) по 0, 5 б. за 3 вещества, 1, 5 балла.
уравнения реакций 2, 5 балла.
2. По 1 б. за каждую оценку рН, всего 9 баллов
3. а) по 0, 5 б. за 5 веществ, 2, 5 балла.
б) по 0, 5 б. за 2 вещества, 1 балл.
4. а) 2 балла, если указано 2 и более реакции 2 балла
б) 4 балла, если указано 4 и более реакции 4 балла
Итого – 25 баллов
Задача 5 (автор Антонов А. А.)
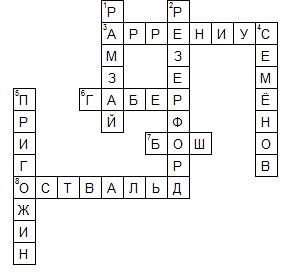
 По горизонтали:
По горизонтали:
3. Сванте Август Аррениус (швед. Svante August Arrhenius; 19 февраля 1859, имение Вейк, недалеко от Уппсалы — 2 октября 1927, Стокгольм) — выдающийся шведский физико-химик, лауреат Нобелевской премии по химии (1903).
Дополнительные вопросы:
а) H3PO2 ⇄ H2PO2– + H+
NaClO2 = Na+ + ClO2–
б) Сульфат бария является нерастворимой солью, значит, в насыщенном растворе сульфата бария будет мало носителей заряда, и раствор практически не будет проводить электрический ток. Перхлорат натрия в воде растворим, при его диссоциации образуются ионы натрия и перхлорат-ионы, которые являются носителями заряда, следовательно, этот раствор будет проводить электрический ток.
 6. Фриц Габер (нем. Fritz Haber, 9 декабря 1868, Бреслау — 29 января 1934, Базель) — немецкий химик, лауреат Нобелевской премии по химии (В 1919 году за 1918 год).
6. Фриц Габер (нем. Fritz Haber, 9 декабря 1868, Бреслау — 29 января 1934, Базель) — немецкий химик, лауреат Нобелевской премии по химии (В 1919 году за 1918 год).
Дополнительные вопросы:
а) N2 + 3H2→ 2NH3
б) Например, с использованием лития (вместо лития можно использовать магний):
6Li + N2→ 2Li3N
Li3N + 3H2O → 3LiOH + NH3
в) Необходимый водород получают конверсией метана, либо газификацией угля:
CH4 + H2O 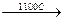 CO + 3H2
CO + 3H2
C + H2O  CO + H2
CO + H2
CO + H2O 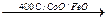 CO2 + H2
CO2 + H2
г) Габер участвовал в разработке и подготовке к использованию первого химического оружия, примененного во время Первой мировой войны. Жена Фрица Габера была категорически против работ по получению химического оружия, и 15 мая 1915 г. она застрелилась после первого применения хлора 22 апреля 1915 г.
 7. Карл Бош (нем. Carl Bosch, 27 августа 1874, Кельн — 26 апреля 1940, Гейдельберг) — немецкий химик.
7. Карл Бош (нем. Carl Bosch, 27 августа 1874, Кельн — 26 апреля 1940, Гейдельберг) — немецкий химик.
Дополнительные вопросы:
а) Нитраты (калия, натрия, аммония) являются составной частью взрывчатых веществ и пороха, а т. к. в Германии практически не было селитряных месторождений, то нитраты необходимо было получать искусственно.
б) Сейчас азот фиксируют для получения удобрений и взрывчатых веществ.
в) В Германии также нет запасов углеводородов, необходимых для получения топлива для техники. При взрывах реакции идут при высоком давлении и высокой температуре и в результате образуются углеводороды:
С + H2O → CO + H2
 nCO + (2n+m)/2H2→ CnHm + nH2O
nCO + (2n+m)/2H2→ CnHm + nH2O
8. Вильгельм Фридрих Оствальд (нем. Wilhelm Friedrich Ostwald, латыш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя — 4 апреля 1932, Лейпциг, Германия) — физико-химик и философ-идеалист, лауреат Нобелевской премии по химии 1909 года.
Дополнительные вопросы:
а) 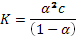 – закон разбавления Оствальда (где a – степень диссоциации, с – концентрация кислоты). Решая квадратное уравнение при концентрации 0, 1 М, получаем a = 0, 013. При разбавлении в 2 раза (т. е. при концентрации 0, 05 М) получаем a = 0, 019. Т. е. степень диссоциации увеличится в 1, 5 раза.
– закон разбавления Оствальда (где a – степень диссоциации, с – концентрация кислоты). Решая квадратное уравнение при концентрации 0, 1 М, получаем a = 0, 013. При разбавлении в 2 раза (т. е. при концентрации 0, 05 М) получаем a = 0, 019. Т. е. степень диссоциации увеличится в 1, 5 раза.
б) В идеальном газе предполагается отсутствие сил притяжения и отталкивания между частицами. В идеальном растворе силы межмолекулярного взаимодействия между частицамирастворителя и растворенного вещества равны. Т. е. в идеальном газе межмолекулярные взаимодействия не учитываются, а в идеальном растворе учитываются.
По вертикали:
 1. Сэр Уильям Рамзай (англ. Sir William Ramsay; 2 октября 1852, Глазго — 23 июля 1916, Хай-Уиком) — английский химик, лауреат Нобелевской премии по химии 1904 года.
1. Сэр Уильям Рамзай (англ. Sir William Ramsay; 2 октября 1852, Глазго — 23 июля 1916, Хай-Уиком) — английский химик, лауреат Нобелевской премии по химии 1904 года.
Дополнительные вопросы:
а) KBrO3 + XeF2 + 2KOH → KBrO4 + Xe + 2KF +H2O
б) Найдем молярную массу газовой смеси:
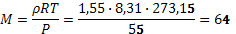 (г/моль), далее допустим, что мольная доля криптона равна x, тогда получим уравнение 84 x + 44(1 – x) = 64, решая его, получаем, что мольная доля криптона равна 50 %. Тогда массовая доля криптона в смеси будет равна w = 0, 5∙ 84 / 64=0, 66.
(г/моль), далее допустим, что мольная доля криптона равна x, тогда получим уравнение 84 x + 44(1 – x) = 64, решая его, получаем, что мольная доля криптона равна 50 %. Тогда массовая доля криптона в смеси будет равна w = 0, 5∙ 84 / 64=0, 66.
 2. Эрнест Резерфорд (англ. Ernest Rutherford; 30 августа 1871, Спринг Грув — 19 октября 1937, Кембридж) — британский физик новозеландского происхождения. Лауреат Нобелевской премии по химии 1908 г.
2. Эрнест Резерфорд (англ. Ernest Rutherford; 30 августа 1871, Спринг Грув — 19 октября 1937, Кембридж) — британский физик новозеландского происхождения. Лауреат Нобелевской премии по химии 1908 г.
Дополнительные вопросы:
а) Уменьшение массового числа может происходить только из-за α -распадов. При каждом α -распаде массовое число уменьшается на 4. Тогда количество α -распадов в ряду – (238 – 206)/4 = 8. При каждом α -распаде количество протонов в ядре уменьшается на 2. Если не происходило ни одного b-распада, то в ядре осталось бы 92 – 8∙ 2 = 76 протона. Однако в ядре свинца 82 протона, значит, в ряду произошло 6 β -распадов.
Определим константу распада для урана-235 и урана-238:
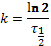 , тогда k 238=1, 55 ∙ 10–10лет, k 235=9, 85 ∙ 10–10лет.
, тогда k 238=1, 55 ∙ 10–10лет, k 235=9, 85 ∙ 10–10лет.
Далее имеем:
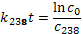

Соответственно с 0 – начальная концентрация 238Uи 235U, t – время, прошедшее с момента образования Земли.
Далее имеем:
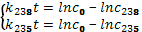
Решая эту систему уравнений, получаем


4. Николай Николаевич Семёнов (3 (15 апреля) 1896, Саратов — 25 сентября 1986, Москва) — советский физико-химик, один из основоположников химической физики, академик АН СССР (1932; член-корреспондент с 1929), единственный советский лауреат Нобелевской премии по химии (получил в 1956 году совместно с Сирилом Хиншелвудом).
 5. Илья Романович Пригожин (фр. Ilya Prigogine; 25 января 1917, Москва, Российская империя — 28 мая 2003 Остин, Техас, США) — бельгийский и американский физик и химик российского происхождения, лауреат Нобелевской премии по химии 1977 года.
5. Илья Романович Пригожин (фр. Ilya Prigogine; 25 января 1917, Москва, Российская империя — 28 мая 2003 Остин, Техас, США) — бельгийский и американский физик и химик российского происхождения, лауреат Нобелевской премии по химии 1977 года.
Система оценивания:
1. По 1 б. за каждого ученого – всего 8 баллов
2. Дополнительные вопросы:
1а. 1 б. за верную реакцию
1б. 1 б. за массовую долю криптона.
2а. по 0, 5 б. за количество a- и β -распадов = 1 б.
2б. 2 б. за определение возраста Земли
3а. по 0, 5 б. за каждое вещество = 1 б.
3б. по 0, 5 б. за каждое вещество = 1 б.
6а. 1 б. за реакцию
6б. 1 б. за получение аммиака из неорганических соединений
6в. 1 б. за получение водорода (0, 5 б. за некрупнотоннажный синтез)
6г. 1 б. за предположение о химическом оружии
7а. 1 б. за важность азота для Германии
7б. 1 б. за связывание азота в наши дни
7в. 1 б. за получение топлива
8а. 2 б. за изменение степени диссоциации
8б. 1 б. за идеальный газ и раствор.
Итого 25 балов
|
|
