
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №10.
|
|
Общая характеристика неметаллов главных подгрупп IV – VII групп (IV-A – VII-A) в связи с их положением в периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов. Изменение окислительно-восстановительных свойств неметаллов на примере элементов VI-A группы.
KKK
При движении сверху вниз по группам увеличивается радиус атома и следовательно уменьшаются окислительные свойства.
Сравнительная характеристика окислительно-восстановительных свойств неметаллов на примере кислорода и серы.
Схемы электронных оболочек:
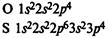
На внешнем электронном уровне атомов кислорода и серы находится по 6 электронов.
У кислорода окислительные свойства выражены сильнее, так как радиус атома меньше и валентные электроны сильнее притягиваются к ядру. Для кислорода наиболее характерна степень окисления —2, проявляющаяся при достройке внешнего энергетического уровня до 8 электронов.
Сера также может являться окислителем, проявляя степень окисления —2, но характерны также степени окисления +4 (при потере 4 р-электронов) и +6 (при потере всех шести валентных электронов).
В реакциях с металлами кислород и сера проявляют окислительные свойства, образуя оксиды и сульфиды соответственно:
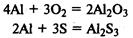
В реакциях с неметаллами кислород проявляет свойства окислителя:
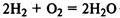
Сера может быть как окислителем
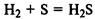
так и восстановителем:
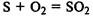
Сера выступает в роли восстановителя в реакции с концентрированной азотной кислотой:
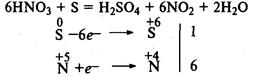
|
|
