
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
PH крови и буф системы.
|
|
механизм действия гемоглобинового буфера
гемоглобиновый буфер состоит из гемоглобина, окигемоглобина и калиевой соли гемоглобина
- гемоглобин НHb содержится в эритроцитах гемоглобин состоит из 4 полипептидных цепей и 4 гемов
гемоглобин НHb – очень слабая кислота (как белок)
НHb ® Hb- + Н+
- внутри клеток высокое содержание К+
в эритроцитах содержится калиевая соль гемоглобина КHb
калиевая соль гемоглобина КHb – сильный электролит
КHb ® Hb- + К+
- гемоглобин состоит из 4 полипептидных цепей и 4 гемов
каждый гем может присоединить 1 молекулу О2 с образованием связи кислорода и Fe2+ гема
O2 + НHb Û НHbO2
оксигемоглобин НHbO2 – кислота, более сильная, чем гемоглобин
HНbO2 Û H+ + HbO2-
- при добавлении кислоты идет реакция кислоты и калиевой соли гемоглобина КHb
Hb- + К+ + H+ + Cl-® НHb + К+ + Cl-
катионы водорода H+ связываются с образованием гемоглобина Hb- + H+® НHb
при добавлении кислоты идет реакция распада оксигемоглобина
H+ + HbO2-® HНbO2 ® O2 + НHb
при увеличении концентрации катионов водорода H+ рановесие реакции смещается вправо
- при добавлении основания идет реакция основания и гемоглобина
НHb + К+ + ОН-® Hb-+ К+ + Н2О
гидроксид-ионы ОH- связываются катионами водорода гемоглобина ОН- + H+ ® Н2О
при добавлении основания идет реакция образования оксигемоглобина
O2 + НHb ® HНbO2 ® H+ + HbO2-
+ К+ + ОН-® HbO2-+ К+ + Н2О
гидроксид-ионы ОH- связываются катионами водорода оксигемоглобина ОН- + H+ ® Н2О
- распад и образование оксигемоглобина согласуется с процессом транспорта кислорода:
более кислая среда в тканевых капиллярах, где накапливаются кислые продукты обмена веществ,
более щелочная среда в легочных капиллярах, где распадается угольная кислота и выводится СO2
64)65)Уравнению Гендерсона-Гассельбаха для расчет рН буферных систем.
буферные растворы сохраняют рН при разбавлении или добавлении небольших количеств к-ты или основания
рН буфера рассчитывают по уравнению Гендерсона-Гассельбаха
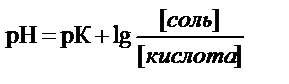
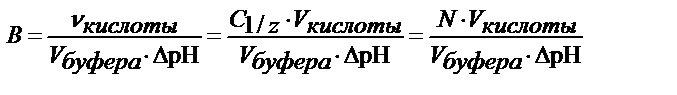
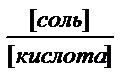
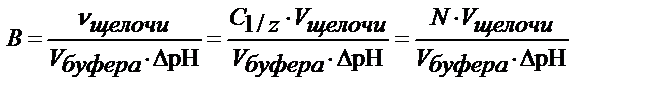
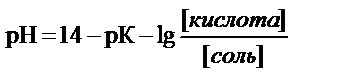
или
где рК – показатель кислотности или показатель основности
факторы, влияющие на рН буфера:
- природа компонетов буфера - показатель кислотности или показатель основности
- соотношение концетраций компонентов буферных растворов
оптимальное соотношение концетраций компонентов буферных растворов не более 10 (lg10=1)
69)Р абочий участок буф системы .зона буферного действия или рабочий участок рН = рК ± 1
- диапазон рН, соответствующий оптимальному соотношению концетраций компонентов буферных растворов
ПР: ацетатный буфер рН = 4, 8 ± 1
гидрокарбонатный буфер рН = 6, 36 ± 1
66) Буферная емкость. 67)Формулы для её расчета по к-ти и щёлочи.
буферные – растворы, сохраняющие рН при разбавлении или добавлении небольших количеств к-ты или основания
способность буферных р-ров сохранять рН ограничена буферной емкостью
буферная емкость – пределы проявления буферного действия
буферная емкость равна числу молей эквивалента сильной к-ты или основания,
которые при добавлении к 1 л буфера меняют его рН на единицу
буферную емкость измеряют в моль/л
различают буферную емкость по кислоте и буферную емкость по щелочи
буферная емкость по кислоте равна числу молей эквивалента сильной кислоты,
которая при добавлении к буферу меняют его рН на единицу
буферная емкость по щелочи равна числу молей эквивалента щелочи,
которая при добавлении к буферу меняют его рН на единицу
где В - буферная емкость
68)Факторы, влияющие на буферную емкость.Максимум буферной ёмкости.
- природа компонетов буфера, тип буфера
- концентрация буферных растворов
- соотношение концетраций компонентов буферных растворов
условия максимальной буферной емкости:
- при равном соотношении компонентов буфера
максимальная буферная емкость у более концентрированных буферных растворов,
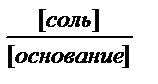
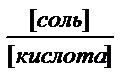
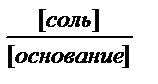 т.к. при добавлении равного количества кислоты или основания
т.к. при добавлении равного количества кислоты или основания
в случае более концентрированных буферных растворов соотношение или
меняется меньше, и меньше изменяется рН
ПР:
- при равных концентрациях буферных растворов
максимальная буферная емкость у растворов с равным соотношением компонентов,
т.к. при добавлении равного количества кислоты или основания
в случае равного соотношения компонентов соотношение или
меняется меньше, и меньше изменяется рН
ПР:
буферы
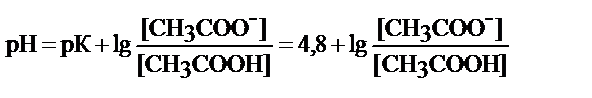 - ацетатный буфер СН3СООН/СН3СОО-
- ацетатный буфер СН3СООН/СН3СОО-
буфер кислотного типа
рабочий участок рН = 4, 8 ± 1
или зона буферного действия рН=3, 8-5, 8
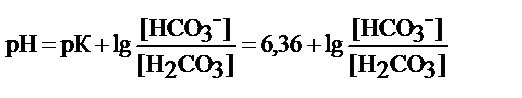 - гидрокарбонатный буфер Н2СО3/НСО3-
- гидрокарбонатный буфер Н2СО3/НСО3-
буфер кислотного типа
рабочий участок рН = 6, 36 ± 1
или зона буферного действия рН=5, 4-7, 4
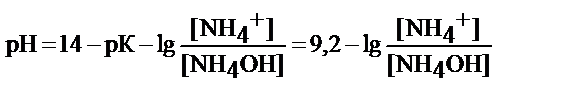
- аммиачный буфер NН4ОН/NH4+
буфер основного типа
рабочий участок рН = 9, 2 ± 1
или зона буферного действия рН=8, 2-10, 2

- фосфатный буфер H2PO-/HPO42-
буфер кислотного типа
рабочий участок рН = 7, 2 ± 1
или зона буферного действия рН=7, 2-10, 2
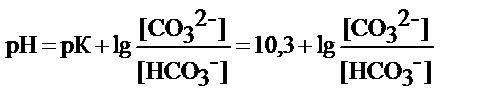
- бикарбонатный буфер НСО3-/СО32-
буфер кислотного типа
рабочий участок рН = 10, 3 ± 1
или зона буферного действия рН=9, 3-11, 3
|
|