
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха.
|
|
фосфатный буфер состоит из солей ортофосфорной кислоты: однозамещенной NaH2PO4 и двузамещенной Na2HPO4
- соли ортофосфорной кислоты – сильные электролиты
Na2HPO4® NaHPO4- + Na+ NaHPO4-® HPO42-+ Na+ HPO42-Û PO43-+ Н+(эта стадия практически, не идет)
NaH2PO4® H2PO4- + Na+ H2PO4-Û HPO42-+ Н+ HPO42-Û PO43-+ Н+(эта стадия практически, не идет)
важно, что H2PO4- - слабая кислота и слабый электролит, NaHPO4- - сильный электролит
- H2PO4- - слабый электролит
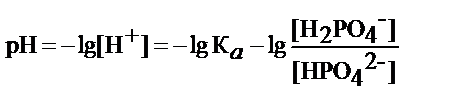
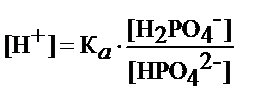
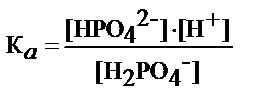 H2PO4-Û HPO42-+ Н+
H2PO4-Û HPO42-+ Н+
где К а - коэффициент диссоциации кислоты H2PO4-
- NaHPO4- - сильный электролит
NaHPO4-® HPO42-+ Na+
NaHPO4-увеличивает концентрацию аниона HPO42-
равновесие реакции H2PO4-Û HPO42-+ Н+ смещается влево
диссоциация H2PO4- тормозится
практически, анион HPO42- образуется только путем диссоциации NaHPO4-
молярная концентрация аниона HPO42- равна молярной концентрации соли [HPO42-]=[NaHPO4-]
- рН фосфатного буфера определяет К а и соотношение концентрации H2PO4-и NaHPO4-
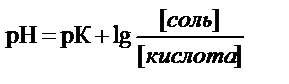
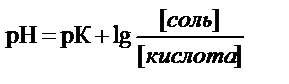
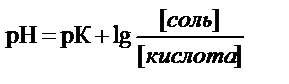
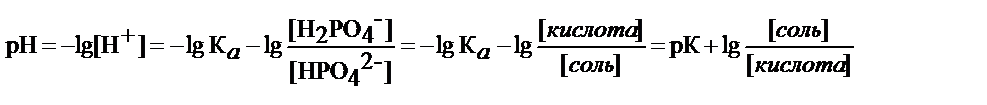
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности кислоты H2PO4-
- при разбавлении фосфатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН фосфатного буфера сохранится
- при добавлении кислоты идет реакция кислоты и NaHPO4-
HPO42-+ Na+ + H+ + Cl- ® H2PO4- + Na+ + Cl-
катионы водорода H+ связываются анионами HPO42-+ H+ ® H2PO4-
рН фосфатного буфера изменится за счет увеличения концентрации H2PO4- и уменьшения HPO42-
механизм изменения рН:
*хотя образуется избыток H2PO4- и
равновесие реакции H2PO4-Û HPO42-+ Н+ смещается вправо,
но по закону Освальда повышение концентрации H2PO4- снижает степень ее диссоциации,
и концентрация катионов водорода H+ увеличивается незначительно,
поэтому при добавлении кислоты рН фосфатного буфера, практически, не изменится
- при добавлении основания идет реакция основания и H2PO4-
H2PO4- + Na+ + ОН- ® HPO42- + Na+ + Н2О
гидроксид-ионы ОH- связываются катионами водорода ОН- + H+ ® Н2О
рН фосфатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона HPO42- и
равновесие реакции H2PO4-Û HPO42-+ Н+ смещается влево,
но по закону Освальда снижение концентрации HPO42- повышает степень ее диссоциации,
и концентрация катионов водорода H+ уменьшается незначительно,
*хотя HPO42- расходуется,
но диссоциируют на катионы водорода H+ только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН фосфатного буфера, практически, не изменится
- при добавлении небольших количеств кислот-щелочей изменение рН фосфатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН фосфатного буфера значительно
|
|