
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм действия аммиачного буфера
|
|
аммиачный буфер состоит из гидроксида аммония Н2СО3 и хлорида аммония NH4Cl
- гидроксид аммония – слабый электролит
NH4OH Û ОH- + NH4+
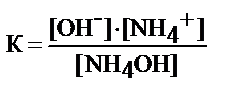

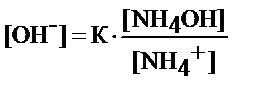
где К=1, 87× 10-5 - коэффициент диссоциации гидроксида аммония
- хлорид аммония – сильный электролит
NH4Cl® Сl- + NH4+
хлорид аммония увеличивает концентрацию аниона Сl-
равновесие реакции NH4OH Û ОH- + NH4+ смещается влево
диссоциация гидроксида аммония тормозится
практически, катион NH4+ образуется только путем диссоциации хлорида аммония NH4Cl
молярная концентрация катион NH4+ равна молярной концентрации соли [NH4+]=[NH4Cl]
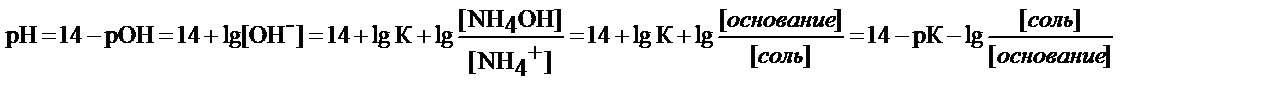 - рН аммиачного буфера определяет К=1, 87× 10-5 и соотношение концентрации гидроксида аммония и NH4Cl
- рН аммиачного буфера определяет К=1, 87× 10-5 и соотношение концентрации гидроксида аммония и NH4Cl
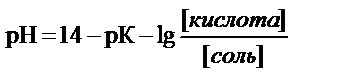
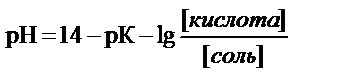
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем основного типа
где рК – показатель основного гидроксида аммония
- при разбавлении аммиачного буфера соотношение концентрации основания и соли не меняется,
поэтому при разбавлении рН аммиачного буфера сохранится
- при добавлении кислоты идет реакция кислоты и гидроксида аммония
NH4OH + H+ + Cl-® NH4+ + Cl- + Н2О
катионы водорода H+ связываются гидроксид-ионами гидроксида аммония ОН- + H+® Н2О
рН аммиачного буфера изменится за счет уменьшения концентрации основания и увеличения соли
механизм изменения рН:
*хотя образуется избыток катионов NH4+ и
равновесие реакции NH4OH Û ОH- + NH4+ смещается влево,
но по закону Освальда снижение концентрации NH4OH повышает степень его диссоциации,
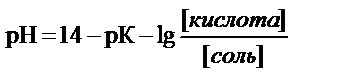 и концентрация гидроксид-ионов ОН- уменьшается незначительно,
и концентрация гидроксид-ионов ОН- уменьшается незначительно,
*хотя гидроксид аммония расходуется,
но диссоциируют на гидроксид-ионы ОН- только часть молекул основания,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении кислоты рН аммонийного буфера, практически, не изменится
- при добавлении основания идет реакция основания и хлорида аммония
NH4+ + Cl- + Na+ + ОН-® NH4OH + Na+ + Cl-
гидроксид-ионы ОH- связываются катионами NH4+ соли ОН- + NH4+® NH4OH
рН аммиачного буфера изменится за счет увеличения концентрации гидроксида аммония и уменьшения соли
механизм изменения рН:
*хотя образуется избыток гидроксида аммония NH4OH и
равновесие реакции NH4OH Û ОH- + NH4+ смещается вправо,
но по закону Освальда повышение концентрации NH4OH снижает степень ее диссоциации,
и концентрация гидроксид-ионы ОН- увеличивается незначительно,
поэтому при добавлении основания рН аммиачного буфера, практически, не изменится
- при добавлении небольших количеств кислот-щелочей изменение рН аммиачного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН аммиачного буфера значительно
|
|