
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Принцип неопределенностей Гейзенберга
|
|
При измерениях динамических переменных в микроскопических системах принцип неопределенностей Гейзенберга, сформулированный им в 1927 г., налагает фундаментальные ограничения на предельную точность измерений, когда речь идет о двух величинах, измеряемых одновременно. Это связано с тем, что свойства микрочастиц настолько своеобразны, а поведение их в такой степени не похоже на поведение окружающих нас в обыденной жизни макроскопических тел, что мы не всегда можем подобрать для них адекватные образы. В данном случае необходимо прибегать к квантово-механическим методам, а это означает, что для описания состояния микрообъектов мы вынуждены пользоваться как волновой, так и корпускулярной картинами.
По описаниям классической физики каждая частица имеет вполне
определенные координаты и импульс, т. е. состояние такой частицы характеризуется определенной точкой в 6-мерном пространстве. Зная импульс частицы и её скорость, можно точно предсказать изменение её координат 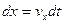 . А если известны силы, действующие на частицу, то можно предсказать изменение её импульса
. А если известны силы, действующие на частицу, то можно предсказать изменение её импульса 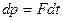 .
.
Таким образом, мы можем всегда определить положение частицы в фазовом пространстве в данный момент, т. е. вычислить её траекторию.
Для частицы же, обладающей как волновыми, так и корпускуляр-ными свойствами, точную траекторию построить не представляется возможным.
Действительно, если мы хотим определить траекторию, то необходимо измерить положение частицы в пространстве, например её координату 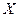 с точностью
с точностью 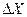 . Чтобы это сделать, необходимо иметь некий микроскоп с соответствующим монохроматическим источником (осветителем), фотоны которого имеют длину волны
. Чтобы это сделать, необходимо иметь некий микроскоп с соответствующим монохроматическим источником (осветителем), фотоны которого имеют длину волны 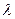 , соизмеримую с длиной волны исследуемой частицы (например, электрона). Но длина волны фотона
, соизмеримую с длиной волны исследуемой частицы (например, электрона). Но длина волны фотона 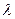 связана с импульсом Р соотношением
связана с импульсом Р соотношением 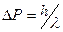 . Этот импульс будет передан и исследуемой частице, в результате чего её собcтвенный импульс изменится на эту же величину
. Этот импульс будет передан и исследуемой частице, в результате чего её собcтвенный импульс изменится на эту же величину 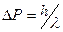 , т. е. чем точнее мы захотим измерить координату частицы, тем большую неопределенность внесем в измеряемое значение импульса
, т. е. чем точнее мы захотим измерить координату частицы, тем большую неопределенность внесем в измеряемое значение импульса  . Таким образом, неопределенности в измерениях координаты и импульса микрочастицы составляют:
. Таким образом, неопределенности в измерениях координаты и импульса микрочастицы составляют:
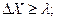
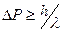 . (2.1)
. (2.1)
Объединив эти соотношения, получим:
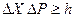 или
или
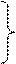
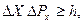
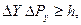 . (2.2)
. (2.2)
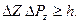
Аналогичные соотношения неопределенностей существуют и для энергии микрочастицы:
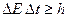 , (2.3)
, (2.3)
где 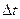 - промежуток времени, в течение которого микрочастица обладает энергией Е от
- промежуток времени, в течение которого микрочастица обладает энергией Е от 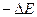 до
до 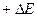 . Это значит, что неопределенность нахождения частицы с данной энергией будет тем больше, чем меньше время пребывания частицы на данном энергетическом уровне.
. Это значит, что неопределенность нахождения частицы с данной энергией будет тем больше, чем меньше время пребывания частицы на данном энергетическом уровне.
Из соотношений (2.1) – (2.3), которые называются соотношениями неопределенностей Гейзенберга, видно, что минимальное действие на частицу равно постоянной Планка h. Это характеризует величину h как минимальный “квант действия”. Эти соотношения к тому же сви-детельствуют о том, что электроны и другие микрочастицы наряду с корпускулярными свойствами проявляют также и свойства волновые. Наличие корпускулярных свойств требует, чтобы частицу можно было локализовать в пространстве и во времени. Но даже приближенная ло-кализация (т. е. определенное значение 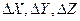 ) ведет к тому, что со-ответствующее волновое поле тоже должно иметь ограниченное про-тяжение. Но известно, что никаким способом невозможно построить волновое поле так, чтобы оно имело ограниченное протяжение и вместе с тем представляло собой непрерывную волну с определенной длиной
) ведет к тому, что со-ответствующее волновое поле тоже должно иметь ограниченное про-тяжение. Но известно, что никаким способом невозможно построить волновое поле так, чтобы оно имело ограниченное протяжение и вместе с тем представляло собой непрерывную волну с определенной длиной 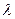 . Возможно либо одно, либо другое: либо гармоническая волна, характеризуемая определенным значением длины
. Возможно либо одно, либо другое: либо гармоническая волна, характеризуемая определенным значением длины 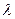 (но такая волна безгранична, а значит, не может быть и речи ни о какой локализации), либо ограниченное волновое поле, но тогда нет волны с определенным значением длины и речь может идти лишь о некотором волновом па-кете, который разлагается в сплошной спектр, где
(но такая волна безгранична, а значит, не может быть и речи ни о какой локализации), либо ограниченное волновое поле, но тогда нет волны с определенным значением длины и речь может идти лишь о некотором волновом па-кете, который разлагается в сплошной спектр, где 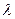 (или волновое число k) непрерывно меняется в определенном интервале (рис. 2.2), тем более широком, чем меньше “ширина” волнового пакета (т. е. чем точнее локализация). Здесь мы как раз и подходим к основной идее принципа неопределенности: наблюдение воздействует на само явление. В принципе давно известно, что, наблюдая какое-то явление, мы неизбежно воздействуем на него.
(или волновое число k) непрерывно меняется в определенном интервале (рис. 2.2), тем более широком, чем меньше “ширина” волнового пакета (т. е. чем точнее локализация). Здесь мы как раз и подходим к основной идее принципа неопределенности: наблюдение воздействует на само явление. В принципе давно известно, что, наблюдая какое-то явление, мы неизбежно воздействуем на него.
Однако при измерениях в макросистемах это воздействие может быть сведено к необходимому (и достаточному) минимуму для обеспечения заданной точности совершенствованием методики измерений или самого СИ. Но при наблюдениях в микромире этим воздействием нельзя пренебречь, нельзя его свести до нуля (или хотя бы уменьшить) никаким совершенствованием прибора.
Не следует, однако, рассматривать соотношения неопределенностей как принципиальную непознаваемость объектов микромира. Просто эти неопре-деленности несущественны при описании движения макрочастиц, но весьма существенны при описании состояний микрочастиц, обладающих как волновыми, так и корпускулярными свойствами. В этом случае мы можем говорить лишь о вероятности того или иного состояния микрочастиц, а сам процесс измерения сводится к определению этих вероятностей.
Эта присущая миру неопределенность особенно наглядно проявляет себя при описании структуры атомов. Допустим, имеется атом водорода и нам необходимо измерить положение электрона. Как известно, такой атом состоит из одного протона, образующего ядро, и электрона, находящегося где-то вне его. Неопределенность в местонахождении электрона такая же, как и размеры самого атома, т. е. мы не можем с уверенностью сказать, где, в какой части атома находится интересующий нас электрон. С уверенностью можно говорить только о вероятности P(r) обнаружения электрона в элементе объема 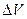 на расстоянии r от протона. Плотность вероятности P(r) для невозмущенного атома водорода находим из выражения:
на расстоянии r от протона. Плотность вероятности P(r) для невозмущенного атома водорода находим из выражения:
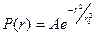 , (2.4) где
, (2.4) где 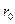 - представляет собой характерную величину радиуса r, после ко-торого функция (2.4) очень быстро убывает (рис. 2.3, а). Несмотря на то, что существует вероятность (хотя и небольшая) обнаружить электрон на большем, чем
- представляет собой характерную величину радиуса r, после ко-торого функция (2.4) очень быстро убывает (рис. 2.3, а). Несмотря на то, что существует вероятность (хотя и небольшая) обнаружить электрон на большем, чем 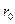 , расстоянии от ядра, именно величину
, расстоянии от ядра, именно величину 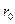 = 0, 528· 10
= 0, 528· 10 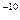 м принято называть “радиусом атома”. Кстати, это же значение атомного радиуса может быть найдено из известных “боровских “соотношений ” [4]:
м принято называть “радиусом атома”. Кстати, это же значение атомного радиуса может быть найдено из известных “боровских “соотношений ” [4]:
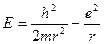 и
и 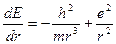 .
.
При 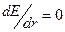 величина
величина 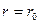 принимает значение 0, 528· 10
принимает значение 0, 528· 10 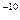 м (так называемый “боровский радиус”). Аналогично вычисляется энергия электрона, соответ-ствующая радиусу
м (так называемый “боровский радиус”). Аналогично вычисляется энергия электрона, соответ-ствующая радиусу 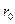 :
:
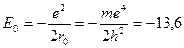 эВ.
эВ.
Если попытаться “наглядно” представить себе атом водорода, то необходимо вообразить себе некое “облако”, плотность которого про-порциональна плотности вероятности. Пример такого облака показан на рис. 2.3, б. Такая наглядная картинка, пожалуй, наиболее близка к истине, хотя тут же следует помнить, что это не реальное электронное облако, а только “ облако вероятностей ”. Где-то внутри него и находится электрон. “Природа позволяет нам только гадать, где же он находится” (Р. Фейнман, Фейнмановские лекции по физике).

 А
А
 P(r)
P(r)

 rо
rо



 x
x


 r
r
“Ширина” а
волнового
пакета Δ x

 а
а




 A(k)
A(k)



rо
ko – Δ k ko+Δ k
 kо б k б
kо б k б
Рис. 2.3. К определению размеров атома [3]:
Рис. 2.2. Волновой пакет шириной 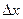 (а) а – плотность вероятности координаты;
(а) а – плотность вероятности координаты;
и спектральный состав б – воображаемый атом водорода (плотность
волнового пакета (б) “облака” пропорциональна плотности вероят-
ности обнаружения электрона)
|
|