
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Константа равновесия
|
|
Поскольку скорость реакций зависит от концентраций реагирующих веществ (6.4) равновесие может установиться при разных равновесных концентрациях исходных реагентов и продуктов реакции. Очевидно, что если концентрации продуктов выше концентраций исходных веществ, то положение равновесия будет ближе к продуктам и наоборот. Большое значение в положении равновесия имеют и значения констант скоростей прямой и обратной реакций. Если константа равновесия прямой реакции больше константы скорости обратной, то независимо от величин равновесных концентраций исходных веществ и продуктов реакции, положение равновесия будет смещено в сторону продуктов. Это утверждение докажем, используя основной закон химической кинетики для реакции 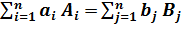 :
:
скорость простой прямой реакции будет равна: vпр=k1 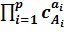 ,
,
скорость простой обратной реакции: vоб=k-1 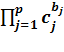 ,
,
Условие равновесия: vпр = vоб, откуда получаем выражение для константы равновесия
Kp = 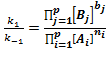 (6.11)
(6.11)
Здесь под знаком произведения стоят равновесные концентрации, которые в состоянии равновесия не меняются во времени. Поэтому константа равновесия есть величина постоянная и не зависящая от концентраций участников реакции. Значение Kp определяется только их видом (то есть значениями  и
и 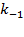 ) и зависит от температуры.
) и зависит от температуры.
|
|