
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основы теории активных соударений
|
|
Современная теория абсолютных скоростей химических реакций состоит из двух основных частей:
- теории активных соударений;
- теории переходного состояния или активированного комплекса.
Для представления основных положений теории активных соударений рассмотрим бимолекулярную реакцию между двумя газами:
A + B = продукты
Химическая реакция – это столкновение молекул А и В. Количество столкновений частиц А и В в единице объема в единицу времени равно скорости реакции:
V = -d[A]/dt = k [A]*[B]
Требуется посчитать nA-B , количество столкновений. Если поделить nA-B на число Авогадро NА, это и будет скорость реакции.
Для упрощения расчетов будем считать молекулы А неподвижными. Тогда молекулы В двигаются относительно А со скоростями V. Предположим, что скорость V – это средняя скорость, одинаковая по модулю и направлению для всех молекул В. Сколько молекул В столкнется с одной молекулой А в единицу времени? Для определения этого рассмотрим цилиндр столкновений.
В основании – молекула А. Опишем из ее центра окружность радиусом d = rА + rВ, rА, rВ.- радиусы частиц А и В. Высота цилиндра - l.
Все молекулы В внутри цилиндра за единицу времени пройдут через его основание и столкнутся с А. Молекулы В вне цилиндра с А не столкнутся. Число столкновений с одной молекулой А равно:
π d2 l nB (6.8.1)
В единице объема присутствует nA штук молекул А. Поэтому всего столкновений между А и В будет
π d2 l nB nA (6.8.2)
Если каждое столкновение ведет к реакции, то
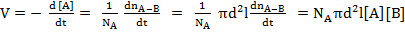 (6.8.3)
(6.8.3)
Сравним (6.8.3) с уравнением закона действия масс и получим выражение для константы скорости:
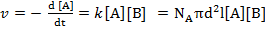 (6.8.4)
(6.8.4)
где k = NA π d2l (6.8.5)
Выразим в уравнении (6.8.5) длину цилиндра l через среднюю скорость молекул V (из распределения Максвелла по скоростям для молекул идеального газа):
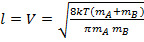 (6.8.6)
(6.8.6)
здесь mA и mB массы молекул А и В, тогда:
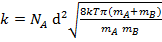 (6.8.7)
(6.8.7)
Поскольку к акту химического превращения приводят только активные соударения, используем распределение Больцмана (6.7.1) и получаем:
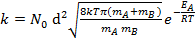 (6.8.8)
(6.8.8)
Данное выражение соответствует уравнению Аррениуса и из него можно сделать вывод – предэкспоненциальный множитель 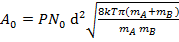 пропорционален Т1/2 и стерическому фактору Р, который учитывает зависимость скорости реакции от взаимной ориентации молекул.
пропорционален Т1/2 и стерическому фактору Р, который учитывает зависимость скорости реакции от взаимной ориентации молекул.
Таким образом, теория активных столкновений позволяет объяснить зависимость скорости реакции и от концентрации реагирующих веществ и от температуры. Однако, влияние энергии активации для различных процессов более полно позволяет учитывать теория активированного комплекса.
|
|