
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 1.2 Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома
|
|
На основании своих наблюдений 1 марта 1869 г Менделеев сформулировал: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов (от их относительных атомных масс)». Уязвимое место Периодического закона – невозможность объяснения причины повторения свойств. Несколько пар элементов (Аr-К, Со-Ni, Те-I, Тh- Рa) расположены с нарушением порядка роста атомной массы. Периодический закон был открыт, когда атом считали неделимым, и о внутреннем строении ничего не было известно. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что в Периодической системе химические элементы расположены в порядке увеличения положительного заряда их атомных ядер.
Современная формулировка периодического закона: свойства химических элементов находятся в периодической зависимости от заряда их атомных ядер.
По мере возрастания зарядов атомных ядер химических элементов периодически изменяется строение их электронных оболочек. Это является причиной периодических изменений свойств элементов.
К основным положениям современной теории строения атома можно отнести следующее:
1. Атом является электронейтральной частицей.
2. Ядро атома состоит из протонов (р) m=1, q=+1, нейтронов (n) m=1, q=0, где число протонов (р) соответствует порядковому номеру химического элемента.
Порядковый номер химического элемента = число l и p. Число нейтронов (n) = относительная атомная масса (Ar) – число протонов (р).
3. Вокруг ядра по сложным орбитам вращаются электроны.
Число l = порядковый номер химического элемента, m = 0, q= -1.В 1927 г. В. Гейзенберг сформулировал принцип неопределенности: невозможно установить местонахождение электрона в атоме, и строго определенная орбита для него никогда не может стать физической реальностью.
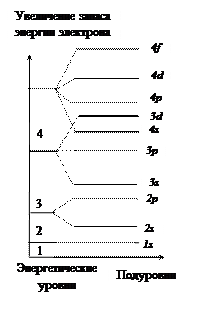
4. Электронная оболочка любого атома – сложная система, она делится на энергетические уровни, отличающиеся друг от друга расстоянием от ядра и запасом энергии.
Число энергетических уровней в атоме = № периода.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| K | L | M | N | O | P | Q |
Максимальное число электронов в квантовом слое (N) рассчитывается по формуле N = 2n2, где n – целое число, обозначающее номер энергетического уровня – главное квантовое число
I период N=2∙ 12=2l s
II период N=2∙ 22=8l s p
III период N=2∙ 32=18l s p d
IV период N=2∙ 42=32l s p d f
2 6 10 14 электронов

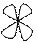
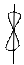 5. Энергетические уровни делятся на подуровни, отличающиеся по формам и размерам
5. Энергетические уровни делятся на подуровни, отличающиеся по формам и размерам
s Å p d f
Максимальное количество электронов на энергетическом подуровне:
s2 p6 d10 f14
Орбиталь –.область возможного нахождения электрона вокруг атомного ядра, совокупность положений электрона в атоме. Квантовая механика вводит понятие электронного облака, то есть заряд электрона размазывается, расплывается по всему объему этого облака. Электронные облака имеют разные геометрические формы.

6. На каждой атомной орбитали может разместиться только 2l с противоположными спинами (веретено) – принцип Паули. Он установил, что в атоме не может быть двух электронов с одинаковыми значениями всех 4 квантовых чисел.
7. Электроны заполняют атомные орбитали, начиная с подуровней с наименьшей энергией (принцип минимума энергии).
1s2< 2s2< 2p6< 3s2< 3p6< 4s2£ 3d10 < 4p6< 5s2 …(ряд В. Клечковского).
 |
8. При наличии свободных орбиталей с одинаковым запасом энергии, каждая орбиталь заполняется вначале наполовину электронами с одинаковыми спинами, а затем полностью с образованием электронной пары, так чтобы их сумма была максимальной (правило Гунда).

Задания для самоконтроля:
Задание № 1. Составьте схему электронного строения, электронную и графическую формулы атомов следующих элементов: а) неон, б) цинк, в) магний, г) кальций, д) аргон, е) алюминий.
Задание № 2. Напишите электронные формулы: а) калия, б) селена, в) скандия, г) кремния, д) ванадия, е) хрома.
Задание № 3. Дайте характеристику химического элемента: а) соединения, которого используются в строительном деле (№ 14), б) обладающего самой высокой электрической проводимостью (№ 47). При характеристике химического элемента следует придерживаться следующего плана:
1) Положение элемента в ПСХЭ Д.И.Менделеева и строение его атома.
2) Характер простого вещества – металл, неметалл или переходный металл.
3) Сравнение свойств заданного простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4) Сравнение свойств заданного простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5) Состав высшего оксида, его характер (основный, кислотный, амфотерный).
6) Состав высшего гидроксида, его характер (кислота, основание, амфотерный гидроксид).
Задание № 4. Определите химический элемент по его электронной формуле.
1) По содержанию этого элемента можно определить пол человека. В волосах женщины его содержание на порядок выше. Электронная формула данного элемента 1s22s22p63s23p64s23d8
2) Этот элемент в сочетании с другими замедляет процессы старения и концентрируется в ногтях. Электронная формула данного элемента 1s22s22p63s23p64s23d3
3) Этот элемент известен как противострессовый биоэлемент, концентрирующийся в твердых тканях зубов. Электронная формула данного элемента 1s22s22p63s2
4) Ядра атомов этого элемента используются в медицине для облучения раковых опухолей. Электронная формула данного элемента 1s22s22p63s23p64s23d7
5) Этот элемент усиливает иммунную защиту организма, способствует увеличению продолжительности жизни. Электронная формула данного элемента 1s22s22p63s23p64s23d104p4
6) Максимальное содержание этого элемента отмечено в сетчатке глаза. Электронная формула данного элемента 1s22s22p63s23p64s23d104p6
7) При недостатке этого элемента приостанавливается рост растений, задерживается созревание плодов. Электронная формула данного элемента 1s22s22p63s23p3
8) Этот химический элемент осуществляет перенос кислорода в организме человека. Электронная формула данного элемента 1s22s22p63s23p64s23d6
9) Когда содержание этого элемента в крови уменьшается, человек начинает «чувствовать погоду». Электронная формула данного элемента 1s22s22p63s23p2
|
|