
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм сокращения
|
|
Аналогично другим типам мышц, повышение концентрации ионов Са2+ в саркоплазме является ключевым моментом в инициации сокращения. Регуляторные белки, которые контролируют процесс сокращения могут находиться либо в цитоплазме, либо на тонком или толстом филаментах. В зависимости от расположения Са-связывающих белков различают актиновый и миозиновый тип регуляции сокращения. Актиновый тип регуляции характерен для сердечной и поперечно-полосатой мышцы, а миозиновый тип регуляции сокращения характерен только для гладкомышечной клетки [210, 324].
Ионы Са2+, попадая в саркоплазму, связываются со специфическим регуляторным белком кальмодулином(аналогом тропонина С), который содержит в своей структуре четыре Са-связывающих участка. Связывание кальмодулина с ионами Са2+ вызывает конформационные изменения структуры кальмодулина, в результате которых комплекс Са-кальмодулин активирует киназу легких цепей миозина [207, 344]. Это фермент из группы протеинкиназ, который способен переносить остаток фосфата АТФ на оксигруппы остатков серина или треонина белка. В покоящейся клетке киназа легких цепей миозина не активна. Причиной отсутствия активности является специальный ингибиторный участок, который закрывает активный центр фермента, тем самым блокируя его активность (рис.12). Активность киназы легких цепей миозина повышается в присутствии ионов Са2+ [151, 207, 247].
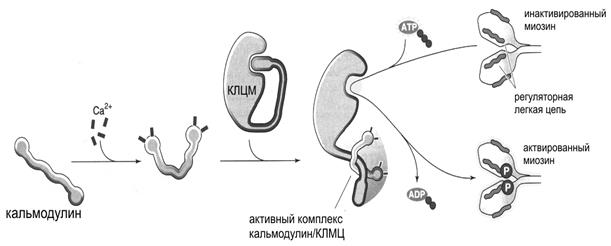
Рис. 12. Схема активации киназы легких цепей миозина (КЛЦМ) и фосфорилирования легких цепей миозина при помощи комплекса Са-кальмодулин.
В последующем киназа легких цепей миозина переносит молекулу фосфата от АТФ на один или два остатка серина регуляторной легкой цепи миозина. Фосфорилирование приводит к структурным изменениям как самой легкой цепи, так и тяжелой цепи в области ее контакта с легкой цепью. Следствием конформационных изменений является значительное повышение АТФ-азной активности миозина, что приводит к взаимодействию миозина с актином. В отличие от скелетной мышцы, в которой АТФ-азная активность миозина довольно высока постоянно, в гладкой мышце сокращение не может начаться до тех пор, пока киназа легких цепей миозина не повысит АТФ-азную активность миозина. В некоторых случаях фосфорилирование легких цепей миозина в слабой степени наблюдается и в отсутствии внешнего стимула. После фосфорилирования легкой цепи миозин взаимодействует с актином, реализуя процесс мышечного сокращения (рис.13).
|
|