
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фармакомеханическое сопряжение
|
|
В некоторых гладких мышцах возбуждающие нейротрансмиттеры и гормоны вызывают сокращение без генерации потенциала действия. Внутриклеточная концентрация ионов кальция в данном случае может повышаться либо путем освобождения Са2+ из саркоплазматического ретикулума либо благодаря входу Са2+ через депо-управляемые каналы. Такой путь сопряжения называется фармако-механическим сопряжением. Независимо от источников, повышение внутриклеточной концентрации Са2+ вызывает сокращение гладкой мышцы [56, 62, 149, 150, 177, 306].
Наиболее важным путем, приводящим к освобождению ионов Са2+ из саркоплазматического ретикулума для гладкой мышцы является путь инозитол-1, 4, 5-трифосфата (рис.13) [181, 363].
Существование этого пути было предположено на основании наблюдения, что некоторые внеклеточные агонисты могут приводить к сокращению гладкой мышцы с минимальной деполяризацией и с незначительным Са2+ входом. В частности, для таких агонистов, как серотонин или норадреналин было замечено, что наблюдаемое повышение концентрации Са2+ в клетке несколько выше, чем если бы оно зависело исключительно от входа Са2+. Следовательно, для этих агонистов существует другой, параллельный путь повышения концентрации Са2+ в клетке и агонисты вызывают сокращение гладкой мышцы, усиливая образование иозитол-1, 4, 5-трифосфата. Инозитол-1, 4, 5-трифосфат связывается со специфическим рецептором на мембране саркоплазматического ретикулума гладкомышечной клетки. Рецепторы к инозитол-1, 4, 5-трифосфату сами по себе являются лиганд-управляемыми Са2+ каналами. Рецептор к инозитол-1, 4, 5-трифосфату (IP3)- это тетрамер, состоящий из мономеров с молекулярной массой 300-350кДа. В настоящее время обнаружено 3 изоформы, которые отличаются по степени чувствительности к инозитол-1, 4, 5-трифосфату. Процесс открытия Са2+канала IP3 рецептора зависит от концентрации ионов Са2+ в саркоплазме, поэтому Са2+ считается ко-активатором IP3-рецептора [307, 186, 363, 346].
Таким образом, активация некоторыми агонистами рецепторов плазматической мембраны может не прямым путем вызывать освобождение Са2+ из саркоплазматического ретикулума и стимулировать сокращение гладкой мышцы.
В состав плазматической мембраны входит фосфолипид фосфатидилинозитол. Часть этой мелкой молекулы, содержащая инозитол, находится на внутренней поверхности мембраны. В результате фосфорилирования образуются две молекулы, играющие существенную роль в механизмах внутриклеточной передачи возбуждения: фосфатидилинозитолфосфат и фосфатидилинозитол-4, 5-бифосфат.
Агонисты активируют серпентинные рецепторы, сцепленные с гетеротримерным G-белком, в результате чего стимулируется фосфолипаза С. Этот фермент специфично расщепляет мембранный липид фосфоинозитол-4, 5-бифосфат с образованием двух вторичных посредников: инозитол-1, 4, 5-трифосфата и диацилглицерола. В результате быстро повышается уровень инозитол-1, 4, 5-трифосфата и диацилглицерола в цитозоле. Оба продукта являются вторичными посредниками. Диацилглицерол остается на мембране и активирует протеинкиназу С, которая мигрирует к мембране из цитозоля. Растворимый в воде инозитол-1, 4, 5-трифосфат свободно проходит через цитозоль и стимулирует освобождение ионов Са2+ из саркоплазматического ретикулума. Таким образом, как инозитол-1, 4, 5-трифосфат, так и диацилглицерол являются продуктами метаболизма мембранных фосфолипидов [13, 291].
Кроме фосфатидилинозитола, в клетке имеется другой, наиболее часто встречающийся фосфолипид, который также может являться источником диацилглицерола. Этим фосфолипидом является фосфатидилхолин. Клетка способна продуцировать диацилглицерол из фосфатидилхолина двумя путями: во-первых, фосфолипаза С способна прямо конвертировать фосфатидилхолин в фосфохолин и диацилглицерол; и во-вторых, фосфолипаза D может конвертировать фосфатидилхолин в холин и фосфо-диацилглицерол. В последующем фосфо-диацилглицерол конвертируется в диацилглицерол при помощи специфической фосфогидролазы.
Рецепторы к инозитол-1, 4, 5-трифосфату представляют из себя лиганд-зависимые Са2+ -каналы, локализованные на мембране саркоплазматического ретикулума, по структуре они относятся к Са2+-освобождающим каналам и отвечают за освобождение ионов Са2+ из саркоплазматического ретикулума.
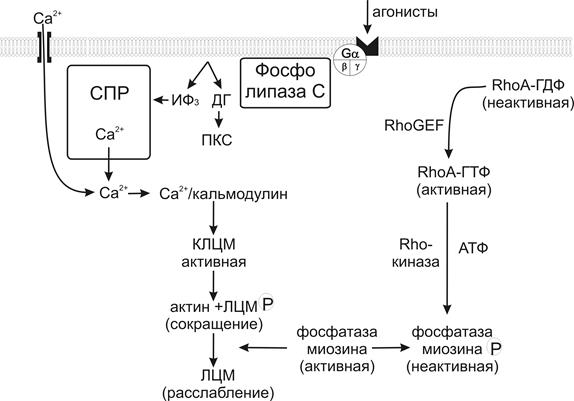
Рис.13. С хема основных механизмов сокращения в гладкомышечной клетке (объяснение в тексте).
СПР - саркоплазматический ретикулум, ИФ3 – инозитол-1, 4, 5-трифосфат, ДГ – диацилглицерол, КЛЦМ – киназа легких цепей миозина, ФЛЦМ – фосфатаза легких цепей миозина.
Взаимодействие инозитол-1, 4, 5-трифосфата с рецептором приводит к пассивному выходу Ca2+ из саркоплазматического ретикулума и, соответственно, к быстрому повышению концентрации свободного Ca2+ в цитозоле. Повышение концентрации Ca2+ может быть кратковременным или продолжительным, может регулярно колебаться, увеличиваясь волнообразно, а также может распространяться на группу клеток, связанных между собой нексусами [21].
Диацилглицерол, совместно с ионами Ca2+, активирует протеинкиназу С, которая фосфоирлирует специфические клеточные белки. В гладкой мышце существует несколько изозимов протеинкиназы С, и у каждой из них специфическая роль. В большинстве случаев протенкиназа С участвует в реализации и регуляции механизма сокращения – фосфорилирует L-тип Са2+каналов или другие белки, регулирующие образование поперечных мостиков.
Кроме возможности инициировать вход Са2+ с помощью лиганд-управляемых каналов (т.е. с помощью каналов, активируемых связанными с G-белком рецепторами), в гладкой мышце существует возможность активировать еще один класс каналов – депо-управляемые Са2+ каналы, который играет чрезвычайно важную роль. Активация этого класса Са2+ каналов происходит следующим образом: нейротрансмиттер или агонист активирует рецептор и, в последующем, фосфолипазу С через G-белок или тирозин-киназу. Фосфолипаза С гидролизует фосфатидилинозитолби фосфат и образуется инозитолтрифосфат, активируются соответствующие Са-каналы саркоплазматического ретикулума, ионы Са2+освобождаются из саркоплазматического ретикулума и запасы Са2+ истощаются. В результате активируются депо-управляемые Са2+ каналы плазматической мембраны. Внеклеточный Са2+ входит через депо-управляемые Са2+ каналы, повышается внутриклеточная концентрация Са2+ и, следовательно, запасы Са2+ в саркоплазматическом ретикулуме восстанавливаются (рис.14) [136, 185].
Сокращение гладкомышечной клетки может не зависеть от внутриклеточной концентрации ионов Са2+. В данном случае сокращение возможно благодаря повышенной чувствительности сократительного аппарата клетки к ионам Са2+, которое подразумевает участие внутриклеточного сигнального пути Rho-киназы [303].
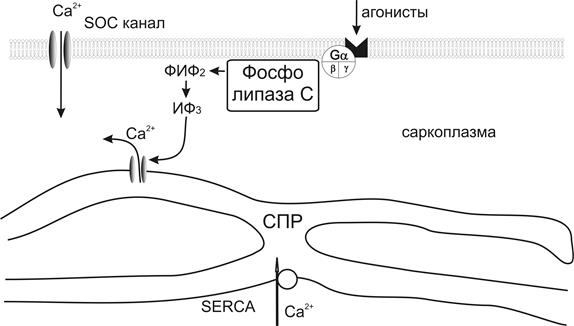
Рис.14. Физиологические пути активации депо-управляемых Са-каналов. ТК-тирозин-киназа, ФИФ2–фосфатидилинозитолбифосфат, ИФ3-инозитолтрифосфат, СПР – саркоплазматический ретикулум, SOCканал – депо-активируемые каналы.
Каким же образом активируется вход ионов Са2+, зависимый от истощения его запасов в клетке? R.S.Lewis (2007) предложил модель активации входа Са, рассматривая плазматическую мембрану и саркоплазматический ретикулум, как единую функциональную единицу, меняющую свое расположение в клетке в зависимости от концентрации ионов Са2+ в саркоплазматическом ретикулуме, образно назвав это изменение «молекулярной хореографией депо-управляемых кальциевых каналов». Прототипом депо-управляемых кальциевых каналов явились так называемые активированные освобождением кальция кальциевые каналы – CRAC каналы (Ca2+-release-activated Са2+ channel). Активным компонентом CRAC канала теплокровных служит Orai1 - белок плазматической мембраны, состоящий из четырех мембранно-связанных участков с N и C внутриклеточными концами. В саркоплазматическом ретикулуме имеется специфический белок STIM1, который является сенсором депо-управляемого кальциевого входа.
В покоящейся клетке с саркоплазматическим ретикулумом, заполненным ионами Са2+, STIM1 и Orai1 распределены довольно равномерно по мембране саркоплазматического ретикулума и плазматической мембране, соответсвенно. Истощение запасов Са2+ приводит к смещению CRAC каналов с Orai1 компонентами и выстраиванию в непосредственной близости от них кластеров STIM1белков. И исключительно в такой ко-локализации возможна активация CRAC канала и вход ионов Са2+ в клетку (рис.15) [185]. Интересно отметить, что в гладкой мышце некоторые стимулы могут вызвать сокращение, не зависимое от значительного увеличения концентрации внутриклеточного кальция. Одним из механизмов является непосредственная модуляция активности сократительных или регуляторных белков. Данный вывод сделан на основании того, что сила сокращения, развиваемая при определенной концентрации внутриклеточного Са2+ может быть различной. Соотношение сила/внутриклеточная концентрация Са2+ может быть повышенным или пониженным. Как правило это соотношение выше при фармакомеханическом сопряжении, чем при электромеханическом сопряжении. В основе развития сокращения гладкой мышцы лежит фосфорилирование легкой цепи миозина. Поэтому Са2+-независимое сокращение может быть результатом как повышения скорости фосфорилирования легких цепей миозина соответствующей киназой, так и понижением скорости дефосфорилирования легких цепей миозина соответствующей фосфатазой. Активность фосфатазы легких цепей миозина может понижаться вторичным внутриклеточным посредником - протеинкиназой С. Следовательно, некоторые возбуждающие импульсы способны инициировать сокращение гладкой мышцы, одновременно вызывая освобождение Са2+ из саркоплазматического ретикулума (с помощью инозитол-1, 4, 5-трифосфата) и уменьшая активность фосфатазы легких цепей миозина (с помощью протеинкиназы С).
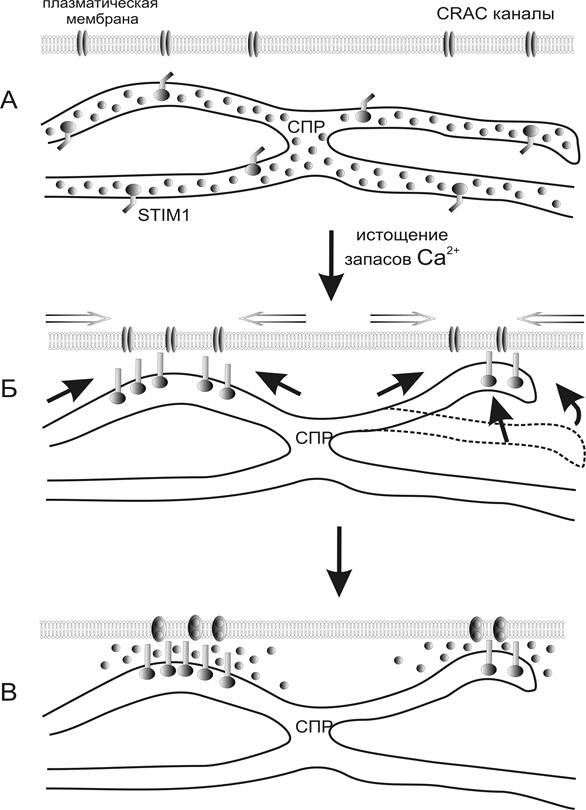
Рис.15. Механизм действия функциональной единицы, состоящей из мембраны, саркоплазматического ретикулума и специфических белков, активация которой приводит к депо-управляемому входу ионов Са.
4.3.3. Са2+ спарки
В процессе инициации сокращения мышечной клетки всех типов основную роль играет увеличение внутриклеточной концентрации ионов кальция. Для гладкомышечной клетки весьма характерны регулярные, кратковременные, локальные выбросы ионов Са2+ из саркоплазматического ретикулума в саркоплазму, которые наблюдаются в непосредственной близости к плазматической мембране – так называемые Са2+ спарки («spark» - вспышка) [34, 146, 201, 375]. Са2+ спарки присущи различным типам гладкомышечных клеток. После активации потенциал-зависимых Са2+ каналов плазматической мембраны и прохождения ионов Са2+ в клетку, активируются кластеры каналов рианодиновых рецепторов, которые представляют из себя ионные каналы саркоплазматического ретикулума, активируемые рианодином. Ионы кальция выходят из саркоплазматического ретикулума в саркоплазму и приводят к появлению спарков (рис.16).
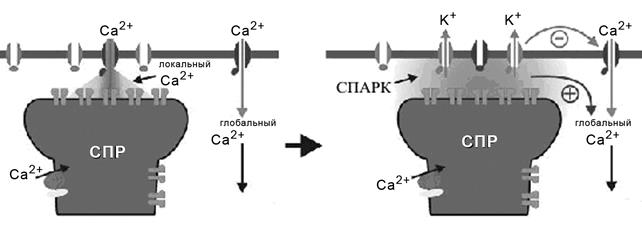
Рис. 16. Возникновение Са2+ спарка (объяснение в тексте).
В гладкой мышце большинство Са2+ спарков наблюдаются в непосредственной близости от плазматической мембраны. Причем, при некоторых условиях концентрация ионов Са2+ вблизи саркоплазмы может быть значительно выше, чем концентрация глобального цитозольного Са2+. Простой Са2+ спарк способен вызвать высокое локальное повышение концентрации ионов Са2+ до 10-100μ М, при этом общий (глобальный) уровень концентрации ионов Са2+ повышается не более чем на 2nM. Са2+ спарки, обладая способностью значительно и локально повышать концентрацию ионов Са2+, способны модулировать активность внутриклеточных ферментов и другие Са2+-регулируемые процессы в клетке, не зависимо от глобального повышения внутриклеточной концентрации ионов Са2+.
В гладкой мышце имеются три важнейших компонента: потенциал-зависимые Са2+ каналы, каналы рианодиновых рецепторов и Са-активируемые К каналы, которые составляют своеобразную функциональную единицу, обеспечивающую регуляцию уровня внутриклеточного Са2+ и процесс сокращения. Общая схема взаимоотношений между ними представлена на рис. 17. В большинстве типов гладкомышечных клеток при возбуждении в первую очередь открываются потенциал-зависимые Са2+ каналы. Вход ионов Са2+ активирует рианодиновые рецепторы, в результате возникает Са2+-спарк. Скорость и эффективность способности потенциал-зависимых Са2+ каналов активировать Са2+ спарк зависит от их близости друг к другу. Вклад Са2+-спарка в общую (глобальную) внутриклеточную концентрацию может быть значительным в фазных гладких мышцах и менее важным в тонических гладких мышцах. Са2+ спарки могут оказывать влияние на работу потенциал-зависимых Са2+ каналов как по механизму отрицательной, так и положительной обратной связи [270, 363].
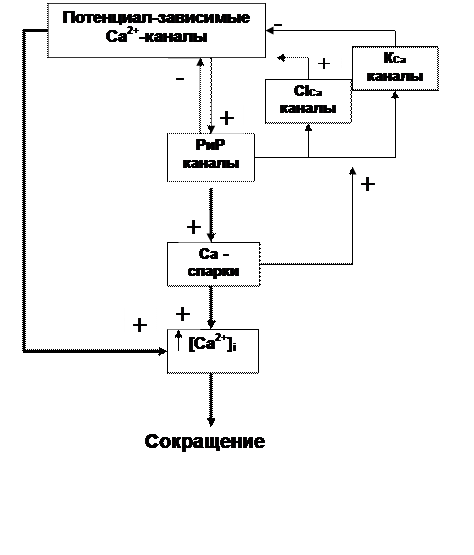
Рис.17. Схема взаимоотношений между потенциал-зависимыми Са2+ каналами, Са2+-каналами рианодиновых рецепторов и Са-активируемыми К+ каналами в гладкомышечной клетке. РиР – канал рианодинового рецептора.
Взаимодействие Са2+ спарка и Са-активируемого К+ канала является местным. По механизму отрицательной обратной связи Са2+ спарк активирует Са-активируемые К+ каналы, что приводит к значительной гиперполяризации мембраны. В результате гиперполяризации потенциал-зависимые Са2+ каналы закрываются. Результатом является уменьшение уровня внутриклеточного Са2+ и расслабление. Эта отрицательная обратная связь может быть чрезвычайно важной для тонических гладких мышц, например, для мышц сосудов. Описываемый механизм лежит в основе действия оксида азота, мощного вазодилятатора, а также других применяемых в клинической практике нитровазодилятаторов, которые, активируя гуанилатциклазу, приводят к увеличению образования цГМФ и последующей активации цГМФ-зависимой протеинкиназыG
С другой стороны, по механизму положительной обратной связи Са2+ спарки активируют Са-активируемые Cl- каналы, что приводит к деполяризации мембраны и, соответственно, к дополнительной активации потенциал-зависимых Са2+ каналов, к увеличению внутриклеточной концентрации Са2+ и к сокращению.
В настоящее время считается, что в процессе реализации физиологических эффектов Са2+ спарков принимают участие внутриклеточные протеинкиназы. Активация протеинкиназы A или протеинкиназы G повышает частоту Са2+ спарков и повышает выход Са2+ из саркоплазматического ретикулума (возможно через активацию АТФ-азы). Повышенная частота Са2+ спарков может быть следствием прямого эффекта на каналы рианодиновых рецепторов и/или является вторичным эффектом повышенного выхода Са2+ из саркоплазматического ретикулума. Кроме этого, активация протеинкиназы A или протеинкиназы G также повышает активность Са-активируемых К+ каналов. Повышенная частота Са2+ спарков и прямая активация Са-активируемых К каналов, синергично приводят к значительному повышению активности Са-активируемых К+ каналов. Последующая гиперполяризация мембранного потенциала закрывает L-тип Са2+ каналов, в результате уменьшается вход Са2+, следовательно, уменьшается концентрация цитозольного Са2+, что в итоге приводит к вазодилятации [16, 17, 33, 51, 161, 171, 215, 253, 269, 326, 341, 360].
В отличие от этого, активация протеинкиназы C понижает частоту Са2+ спарков благодаря прямому ингибиторному эффекту на каналы рианодиновых рецепторов и Са-активируемые К+ каналы, соответственно. В результате возникает деполяризация мембраны и активация L-типа Са2+ каналов (рис.18).
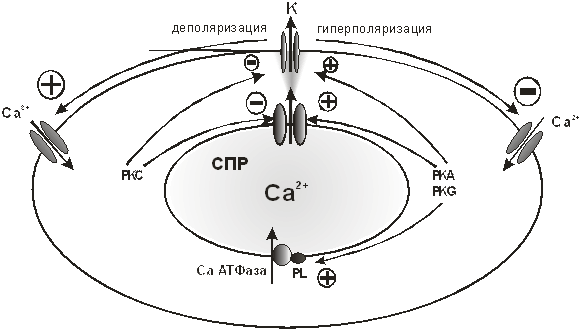
Рис. 18. Са2+ спарки. Возможные механизмы действия протеинкиназы А (PKA), протеинкиназы С (PKC) и протеинкиназы G (PKG) на Са2+ спарки, Са-активируемые-К+ каналы и Са2+ АТФ-азу саркоплазматического ретикулума в гладкомышечных клетках артерий. Pl – фосфоламбан.
Модуляция частоты и амплитуды Са2+ спарков в гладкой мышце приводит к регуляции уровня мембранного потенциала и контролю сократимости гладкой мышцы. Протеинкиназа А, протеинкиназа G и протеинкиназа С имеют исключительно важное значение в модуляции частоты и амплитуды Са2+ спарков. Эти киназы приводят в действие координированную и согласованную работу ключевых элементов Са2+ сигнализации, включая потенциал-зависимые Са2+ каналы, каналы рианодиновых рецепторов, фосфоламбан, и Са-активируемые К+ каналы. Конкретные молекулярные мишени, которые определяют частоту и амплитуду модуляции Са2+ спарков различными киназами пока еще не понятны. Однако, несомненно, модуляция Са2+ спарков имеет важное значение в регуляции функций гладких мышц [281].
|
|