
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическое введение. Всякий гетерогенный процесс включает в себя несколько стадий
|
|
Всякий гетерогенный процесс включает в себя несколько стадий. Как правило, основные из них - транспорт реагирующих веществ к реакционной поверхности, собственно химическая реакция, отвод продуктов реакции в объем. В зависимости от условий проведения процесса и его особенностей наиболее медленной может быть любая из трех стадий. Если лимитирующими являются первая и третья стадии, то скорость процесса зависит от скорости переноса вещества посредством диффузии. Такой процесс называют диффузионным.
Большое значение имеют диффузионные влияния в процессах испарения жидкостей и сублимации твердых тел. Они играют ведущую роль при сушке, перегонке и т.д. – везде, где скорость процесса лимитируется отводом пара от поверхности конденсированной фазы. Процесс диффузии подчиняется первому закону Фика
Y = -D(dC/dx), (49)
где Y = 1/S´ dm/dt - количество m вещества, проходящее за время dt через сечение S (диффузионный поток, г/см2´ с); D – коэффициент диффузии; dC/dx – градиент концентрации.
Знак «-» показывает, что диффузия идет в направлении убывания концентрации. Величина D представляет собой удельную скорость диффузии, т.е. количество вещества, проходящего в единицу времени через единицу поверхности при единичном градиенте концентрации. Как следует из выражения (1), коэффициент D имеет размерность D = (длина)2/время, а выражают его обычно в см2/с.
Кинетическая сторона диффузии ясна из следующих рассуждений. Если на границе раздела фаз концентрация испаряющегося вещества равна Сs, а на расстоянии d - С и равна концентрации в глубине объема V, то можно приближенно заменить
- dC/dx = (Cs- C)/d (50)
и I = D´ (Cs – C)/d. (51)
Разделив обе части уравнения (3) на объем и переходя к концентрации, получим
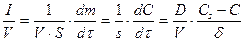 . (52)
. (52)
Отсюда скорость диффузии запишется
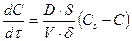 . (53)
. (53)
Таким образом, скорость диффузии кинетически подчиняется уравнению первого порядка относительно концентрации в объеме. Интегрирование (53) дает обычное выражение для константы массопереноса b = DS/Vd, которая является аналогом константы скорости
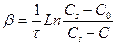 , (54)
, (54)
где С0 – начальная концентрация диффундирующего вещества в объеме.
Диффузия – процесс относительно медленный. Это объясняется тем, что каждая молекула диффундирующего вещества испытывает огромное число соударений и перемещается по сложной траектории, длина которой несоизмеримо велика по сравнению с расстоянием, проходимым молекулой в направлении диффузии.
Вследствие этого лишь небольшая часть молекул, вырвавшихся из жидкости, успевает удалиться от ее поверхности на значительное расстояние. В тонком слое газа над самой поверхностью накапливаются молекулы испаряющегося вещества, и парциальное давление паров растет до тех пор, пока не станет почти равным давлению насыщенного пара. В общем случае говорят: если процесс лимитируется диффузией, то около поверхности раздела фаз устанавливается состояние, близкое к равновесному.
Для экспериментального определения коэффициентов диффузии чаще всего создают такие условия, в которых процесс испарения и диффузии паров протекает стационарно. В стационарном процессе скорость его, а также концентрация вещества в любой точке системы не меняются со временем. Такой процесс диффузии легко рассчитать.
Например, для описания скорости стационарного испарения жидкости в вертикальной цилиндрической трубе, у верхнего среза которой поддерживается постоянное парциальное давление паров Р0, Стефан получил уравнение
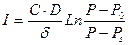 , (55)
, (55)
которое позволяет выразить коэффициент диффузии через измеряемые в опыте величины
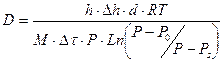 , (56)
, (56)
где С = МР/РТ – концентрация диффундирующего вещества (г/см3), соответствующая его парциальному давлению, которое равно общему атмосферному давлению Р; М – молекулярный вес жидкости; Рs – давление насыщенных паров жидкости при температуре Т; d – плотность жидкости; h - расстояние от поверхности жидкости до верхнего среза трубы; Dh – измерение высоты уровня жидкости в результате испарения за время Dt; R – универсальная газовая постоянная.
С повышением температуры коэффициент диффузии возрастает экспоненциально в жидкостях и твердых телах
D = D0exp(-E/RT) (57)
и по степенной зависимости в газах
D2/D1 = (T2/T1)n. (58)
Значение показателя степени в последнем уравнении лежит обычно в пределах 1, 6-2, 0.
Анализ нестационарного процесса испарения жидкости из вертикальной цилиндрической трубы показывает, что данный процесс должен подчиняться уравнению
 , (59)
, (59)
где х – расстояние, на которое переместилась в трубке граница жидкость-пар за время t; С20 – концентрация воздуха на межфазной границе (кг/м3); С10 – концентрация насыщенного пара жидкости на границе (кг/м3); С = С10 + С20.
Экспериментальная часть
В держатели штатива зажимают две тонкие (4-6 мм диаметром) стеклянные пробирки. Одна из них служит для определения коэффициентов диффузии пара жидкости при стационарном процессе испарения по уравнению Стефана (8) (метод 1), другая – для расчета скорости нестационарного испарения по уравнению (11) (метод 2).
Метод 1. Исследуемую жидкость наливают в пробирку на 50-80 мм ниже ее верхнего среза. Через 30 мин, в течение которых происходит установление стационарного состояния, начинают измерения при помощи катетометра. Измерять Dh нужно с большой точностью, так как испарение идет медленно и Dh выражается десятыми долями миллиметра. Отсчеты снимают через 20-40 мин. За время опыта снимают 6-7 отсчетов и строят график Dh, t, позволяющий судить о стационарности процесса испарения (dh/dt = const). По уравнению (8) рассчитывают коэффициент диффузии пара жидкости в воздухе. За высоту h принимают среднее ее значение за время опыта (высота диффузионного пространства).
Измерения заносят в таблицу и представляют в виде графиков:
1) h = f(t);
2) Dh / Dt = f(t).
Метод 2. Пробирку заполняют исследуемой жидкостью полностью до верхнего среза. Измерения перемещения межфазной границы во времени производят микрометром, постепенно увеличивая время между измерениями от 15-20 до 40-45 мин. Всего снимают 6-7 отсчетов.
Измерения заносят в таблицу и представляют в виде графиков:
1) х = f(t);
2) х2 = f(t);
3) зависимость скорости испарения I = id от t и t-1.
i – скорость перемещения межфазной границы, i = dx/dt. По тангенсу угла наклона графика с учетом давления насыщенного пара исследуемой жидкости при температуре опыта рассчитывают D и сравнивают с полученным значением по методу 1 и литературным данным.
Расчет поверхностных концентраций для метода 2 описан в работе 5.
Контрольные вопросы
1. Как зависит скорость испарения жидкости от температуры?
2. Каковы признаки диффузионного торможения гетерогенного химического процесса?
3. Каков порядок реакции, которая лимитируется диффузией?
4. Назовите примеры химико-технологических процессов, где важно знать закономерности массопереноса.
Лабораторная работа 9
|
|