
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методика эксперимента. Реакция омыления уксусноэтилового эфира
|
|
Реакция омыления уксусноэтилового эфира
CH3COOC2H5 + NaOH = CH3COONa + C2H5OH (29)
протекает по второму порядку. Если исходные концентрации эфира и щелочи не одинаковы и равны соответственно a и b молей, то дифференциальное кинетическое уравнение имеет вид:
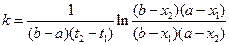 , (30)
, (30)
где x 1 и x 2 – концентрации CH3COONa или C2H5OH, образовавшихся соответственно к моменту времени t1 и t2. Для опыта берут две 100 мл колбы, в одну наливают пипеткой или из бюретки 50 мл 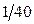 н раствор NaOH, в другую – 55…60 мл
н раствор NaOH, в другую – 55…60 мл 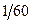 н раствор CH3COOC2H5. Колбы закрывают пробками и помещают в термостат с температурой 25°С до выравнивания температур. Наполняют бюретку 0, 01 н раствором соляной кислоты (для титрования щелочи), а в холодильник (или на лёд) ставят колбу объемом 500 мл с дистиллированной водой. После того, как температура растворов в колбах сравнялась с температурой термостата отбирают пипеткой 50 мл нагретого в термостате уксусноэтилового эфира и приливают в колбу с раствором гидроксида натрия и в момент смешения включают секундомер. Реакционную смесь перемешивают и оставляют в термостате.
н раствор CH3COOC2H5. Колбы закрывают пробками и помещают в термостат с температурой 25°С до выравнивания температур. Наполняют бюретку 0, 01 н раствором соляной кислоты (для титрования щелочи), а в холодильник (или на лёд) ставят колбу объемом 500 мл с дистиллированной водой. После того, как температура растворов в колбах сравнялась с температурой термостата отбирают пипеткой 50 мл нагретого в термостате уксусноэтилового эфира и приливают в колбу с раствором гидроксида натрия и в момент смешения включают секундомер. Реакционную смесь перемешивают и оставляют в термостате.
В коническую колбу для титрования наливают мерным цилиндром 50 мл охлаждённой воды и 3 капли спиртового раствора фенолфталеина. Через 4 мин после смешения растворов эфира и щелочи пипеткой на 10 мл отбирают 10 мл смеси и в момент времени, отвечающий ровно 5 мин после начала реакции, вливают отобранный объём в колбу для титрования. Пробу немедленно титруют раствором соляной кислоты до обесцвечивания раствора. По окончании титрования колбу споласкивают водой и перед взятием следующей пробы также наливают 50 мл охлаждённой воды и 3 капли фенолфталеина. Через 14 мин берут следующую пробу и точно через 15 мин вливают её в колбу для титрования. Последующие титрования проводят через 25, 40 и 60 мин после начала реакции.
Для вычисления константы скорости необходимо сделать еще одно титрование, отвечающее практически полному завершению реакции омыления. Чтобы ускорить окончание, последнюю пробу нужно нагреть. Для этого в чистую колбочку переносят 10 мл реакционной смеси, закрывают колбочку пробкой со вставленной в нее длинной стеклянной трубкой, служащей обратным холодильником, и помещают в баню с кипящей водой на 30-40 мин. Затем колбочку с пробой охлаждают под краном и в ней же титруют смесь.
При вычислении константы скорости входящие в уравнение (30) разности концентраций (b-a), (a- х ¢), (a- х ²), (b- х ¢) и (b- х ²) заменяют пропорциональными им объемами 0, 01 н раствора соляной кислоты, израсходованными на титрование или определенными из результатов титрования.
Разность (b-a) заменяется пропорциональным ей объемом соляной кислоты, затраченным на последнее титрование. Разности (b-х¢) и (b-х²), равные концентрациям непрореагировавшей щелочи к моменту времени t1 и t2, очевидно пропорциональны израсходованным на титрование объемам соляной кислоты V¢ и V² и, наконец, разности (a-х¢) и (a-х²), заменяются соответственно (V¢ -V¥ ) и (V² -V¥ ). После подстановки в (30) получим:
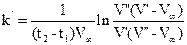 . (31)
. (31)
k¢ в этом уравнении не равно k в (30), так как разность (b-a) заменена пропорциональной, но не равной величиной V¥ . Однако, величины k¢ и k пропорциональны друг другу. По уравнению (31) вычисляют константу скорости для различных промежутков времени, например, 5-15, 5-25, 5-25, 25-40, 40-60 мин и т.д. и находят её среднее значение.
Такой же опыт повторяют при другой, более высокой температуре, например, при 35°С. Пo двум значениям констант скоростей 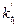 и
и 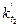 вычисляют энергию активации по уравнению (6).
вычисляют энергию активации по уравнению (6).
Результаты наблюдений и расчетов представляют по форме таблицы 3.
Таблица 3.
Расход соляной кислоты и кинетические параметры реакции омыления
уксусно-этилового эфира щелочью при различных температурах
| Время от начала опыта t i, мин. | T1= К | T2= К | Энергия активации, Е | ||||||
| Объем на титрование Vi, мл | V i -V¥ , мл |
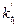
|
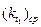
| Объем на титрование Vi, мл | V i -V¥ , мл |
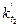
|
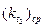
| ||
| ¥ |
|
|