
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Антропогенное воздействие на природную среду и его последствия
|
|
Объективная оценка последствий антропогенной деятельности возможна лишь при рассмотрении природной среды как сложной системы, развивающейся по свои законам, которые должны учитывать человеком в его деятельности.
Системный взгляд на природную среду отражается в понятии биосфера (которым обозначается область существования жизни на Земле).
По определению В.И. Вернадского биосфера включает в себя компоненты неживой природы:
· Литосферу (верхний слой земной коры)
· Атмосферу (ее нижний слой)
· Гидросферу (водную оболочку)
А так же важнейший элемент – совокупность живых организмов («живое вещество» - по Вернадскому) – мощный фактор воздействия на неживую природу и ее преобразования
Биосфера – динамическая система, в которой происходит непрерывное перемещение вещества. В то же время она обладает определенной устойчивостью - способна к саморегулированию и сохранению своей структуры при изменении внешних условий.
Для биосферы характерным является не просто поступательное перемещение вещества, а круговорот веществ, т.е. циклический процесс обмена веществом между различными компонентами биосферы в результате совокупности химических и биохимических превращений.
Круговорот совершают все химические элементы. Эти процессы не изолированы друг от друга, частично перекрываются и согласованы (сбалансированы) меду собой. Существование множества согласованных циклических процессов обмена химическими элементами между различными компонентами биосферы и обуславливает ее устойчивость к воздействиям внешних возбуждающих факторов, е числу которых относится и человеческая деятельность.
Можно выделить 2 основных аспекта (вида) антропогенного воздействия на окружающую среду, сопровождающаяся негативными последствиями.
1. Поступление в окружающую среду химических веществ, чуждых природе, несвойственных живым организмам (является результатом органического синтеза - ксенобиотиков).
Последствия поступления в ОС синтезированных человеком веществ может быть разнообразным. Ряд веществ – ксенобиотиков – несут прямую угрозу живым организмам, в первую очередь высшим, поскольку являются сильными ядами для них (пестициды, ПХБ). Другие вещества (химически не опасные для живого) в ОС так же могут привести к пагубны последствиям – прекрасная иллюстрация ФХУ, которые первоначально казались абсолютно безвредными для ОС, но в конечном итоге привели к такой ситуации (нарушение озонового слоя), что жизнь на Земле в определенной мере оказалась под угрозой. Отсюда задача науки ХОС – оценка поведения этих веществ в ОС, влияние их на природные процессы.
2. Изменения в природных круговоротах в результате добавления или удаления присутствующих в них химических веществ в ходе человеческой деятельности, что влияет на устойчивость биосферы.
Природные круговороты претерпевают неестественные изменения. Но естественные изменения в природной среде происходят так медленно, что для всего живого сохранятся возможность приспособится генетически к этим изменениям. Человек ускоряет движение лишних веществ, так что возможно нарушение цикличности. В результате в одних местах возможен избыток, в других недостаток того или иного вещества. При антропогенном вмешательстве для такого приспособления времени и шансов мало и последствия могут быть весьма существенными.
Хозяйственная деятельность затрагивает не один какой либо природный круговорот, а все без исключения. Отсюда следует, что одной из важных задач науки ХОС является тщательный анализ природных круговоротов отдельных химических элементов с целью выявления антропогенных нарушений в них и оценки последствий этих нарушений.
Учитывая это, рассмотрим круговороты основных биогенных элементов (составляющих основу живых организмов) С, О, N, P, S в биосфере и попытаемся оценить изменения в этих эволюционно сложившихся круговоротах, вызванных человеком и возможные последствия этих изменений.
КРУГОВОРОТ ВЕЩЕСТВ В ПРИРОДЕ
ЗАКОНОМЕРНОСТИ РАСПРЕДЕЛЕНИЯ ВЕЩЕСТВ
В ОКРУЖАЮЩЕЙ СРЕДЕ
Круговорот углерода
Углерод составляет основу всех жизненных процессов в организмах он же в огромных масштабах вовлекается в хозяйственную деятельность. Таким образом круговорот С – весьма удобный объект для анализ проблем, вызванных антропогенным воздействием на круговорот веществ в природе.
Резервуарами углерода, участвующего в круговороте, являются все геосферы – атмосфера, гидросфера, литосфера. Масса углерода в этих резервуарах соотносится примерно как 1: 50: 1300.
В атмосфер е практически весь углерод содержится в форме СО2. В гидросфере (главным образом в океанах – основном резервуаре гидросферы) углерод присутствует в преимуществен но в неорганической форме - в виде НСО3- - (на долю органического углерода приходится около 2% от общей массы).
Наибольшее количество углерода в целом (и СО2) сосредоточено в литосфере. Однако углерод литосферы медленно вовлекается в естественные биохимические процессы, таки образом биохимический цикл углерода преимущественно охватывает атмосферу и гидросферу.
Самый важный компонент природного цикла углерода – газообразный СО2 , таким образом рассматривая цикл углерода, естественно рассматривают прежде всего СО2 и процессы с его участием.
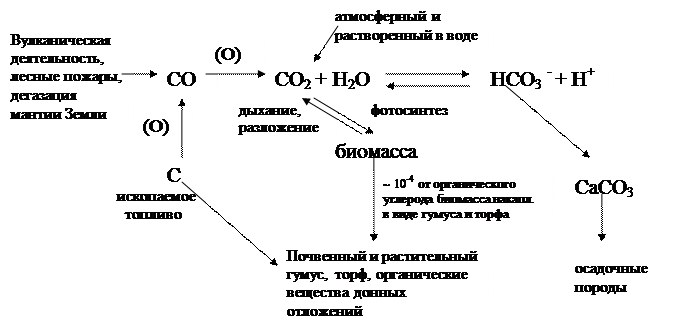 Круговорот С в биосфере (биогеохимический цикл) можно представить схемой (рис 1 раздатка):
Круговорот С в биосфере (биогеохимический цикл) можно представить схемой (рис 1 раздатка):
СО2, находящийся в атмосфере, является основным источником наращивания биомассы (при действии организмов - продуцентов). В процессе фотосинтеза СО2 превращается в углеводы, которые затем в процессах биосинтеза превращаются в белки и т.п. (благодаря организмам-консументам, синтезирующим разнообразные вещества).
Часть С в виде СО2 в процессе дыхания живых организмов возвращается в атмосферу. При микробиологическом разложении органических веществ погибших организмов СО2 также возвращается в цикл и он (цикл) таким образом замыкается.
Очень важную роль в круговороте углерода играет газообмен между атмосферой и гидросферой (водами мирового океана). Растворенный в воде СО2 частично потребляется фитопланктоном, расходуясь на фотосинтез, и затем высвобождается в результате деятельности деструкторов, т.е. включается в круговорот. Океаническая вода содержит значительные количества ионов Са2+ и Mg2+ . При растворении СО2 в морской воде образуется карбонатная система, которая описывается равновесием:
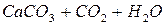
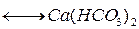
Это равновесие зависит от парциального давления СО2 в атмосфере и от температуры. Концентрация СО2 в поверхностных слоях воды является равновесной в его одержанием в атмосфере при заданных условиях (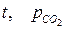 ). При повышении концентрации СО2 в атмосфере повышается его содержание в морской воде и происходит сдвиг равновесия в сторону образования бикарбонатов. При снижении концентрации СО2 в атмосфере возможна дегазация вод океана, сопровождающаяся выделением СО2 . Таки образом мировой океан играет роль своеобразного буфера, сглаживающего колебания содержания СО2 в атмосфере.
). При повышении концентрации СО2 в атмосфере повышается его содержание в морской воде и происходит сдвиг равновесия в сторону образования бикарбонатов. При снижении концентрации СО2 в атмосфере возможна дегазация вод океана, сопровождающаяся выделением СО2 . Таки образом мировой океан играет роль своеобразного буфера, сглаживающего колебания содержания СО2 в атмосфере.
Биосферный цикл углерода замкнут не полностью, т.е. не весь углерод, вовлекаемый в фотосинтез, возвращается в цикл. Часть углерода выводится из биосферы в своеобразные биологические тупики:
1. осаждается в виде карбонатов (в водной среде) из которых формируются осадочные породы;
2. накапливаются в виде гумуса в почве и торфа, формирующихся из остатков погибших растений и животных организмов, или в виде донных отложений (органический углерод гумуса в силу особенности строения не может быть использован живыми организмами – геополимеры гумуса устойчивы к микробиологическому разложению);
3. накапливаются в виде органического углерода ископаемых топлив, формирующихся в определенных условиях.
Естественными процессами, обусловливающими пополнение цикла углерода углекислым газом является вулканическая деятельность, лесные пожары, дегазация мантии Земли. Наряду с ними к дополнительному внесению СО2 в цикл является и хозяйственная деятельность. Именно это является главным фактором вмешательства хозяйственной деятельности в естественный круговорот углерода.
Деятельность человека сопровождается интенсивным возвращением в круговорот С запасов углерода, находящихся в природных залежах. (т.е. временно выключенных из круговорота)
· прежде всего в результате сжигания органического топлива, что приводит к поступлению в атмосферу колоссальных количеств CO2
· значительный аналогичный вклад вносит металлургия, производство строительных материалов (цемента: 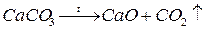 )
)
· дополнительное количество СО2 поступает в атмосферу, например при выпадении кислотных дождей в районах с карбонатными породами, при сельскохозяйственных мероприятиях по известкованию почв.
По некоторым оценкам ежегодное поступление СО2 в атмосферу в результате хозяйственной деятельности примерно в 100 раз превышает его поступление вследствие геологических процессов и составляет до 10% биогенного потока СО2 в атмосферу.
Есть ряд природных факторов, способствующих связыванию СО2 и препятствующих накоплению СО2 в цикле.
· Рост биомассы
· Образование гумуса в почвах
· Усиление процесса выветривания минералов ведущих к образованию карбонатов
· и главный фактор – поглощение избыточного СО2 мировым океаном.
Однако антропогенное давление на ОС в настоящее время таково, что баланс СО2 нарушен, его содержание непрерывно увеличивается - прирост за последние 100 лет около 15% и темпы растут.
В тоже время накопление СО2 в атмосфере способно существенно повлиять на климат, т.е. масштабы и тепы использования ископаемого топлива несут серьезную угрозу глобальных изменений климата, последствия которых трудно оценить, но по общему мнению – они отрицательны для развития цивилизации.
Круговорот кислорода. Фотосинтез.
В процессах составляющих основу круговорота О2 участвует кислород, присутствующий в атмосфере.
В атмосфере содержится 1, 2*1015 тонн О2 . Главный источник кислорода – фотосинтез, который дает около 2, 5*1011 тонн/год. Другой источник – фотодиссоциация молекул Н2О дает примерно 2*106 тонн О2 в год, т.е. на несколько порядков меньше.
Свободный кислород будучи окислителем участвует в геохимических процессах окисляя восстановленные формы элементов
 и др.
и др.
Окисление органических веществ(СН4), N2 в сумме не более 1% от общего расхода.
Основная масса О2 используется для обеспечения:
1. жизнедеятельности (дыхание)
2. микробиологической деструкции органических веществ
3. очень небольшую долю составляет расход О2 в производственных процессах (сжигание топлива, технологические процессы).
Таким образом образование и потребление О2 происходит практически в замкнутом цикле фотосинтеза и деструкции органического вещества в биосфере и цикл О2 можно представить простой схемой (рис 2 раздатка).
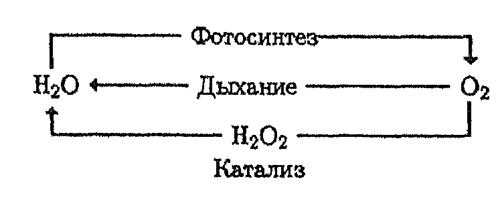
Фотохимические процессы составляют основу круговорота О2 и его соединений (Н2О, СО2). Они протекают в фотосинтезирующих организмах – растениях. Фотосинтезирующие организмы составляют около 90% биомассы всех живых организмов на Земле, общая же биомасса животных примерно 0, 1% биомассы растений, таки образом вклад животных в биологический круговорот О2 пренебрежимо мал в сравнении с вкладом автотрофных растений и микроорганизмов.
Источником фотосинтетического О2 являются континентальная и морская растительность. Причем почти половину его общего количества (по разны источникам от 30 до 50%) образуется за счет фитопланктона (микроскопических водорослей), содержащегося в верхних слоях вод морей и океанов, хотя биомасса фитопланктона существенно меньше биомассы континентальной растительности.
Фотосинтез – процесс образования глюкозы из двух простых соединений Н2О и СО2 , протекающий при освещении под действием катализатора, которым является хлорофилл, содержащийся в клетках листьев зеленых растений или водорослей. Суммарная химическая реакция процесса фотосинтеза выражается уравнением:
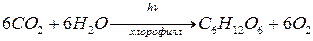
Глюкоза служит исходным материалом для формирования растений
По-существу, фотосинтез, - процесс преобразования энергии солнечного излучения в химическую энергию (протекающей с достаточно высокой эффективностью ~ 5 %)
Фундаментальный процесс запасания солнечной энергии в виде химической при фотосинтезе – окисление воды до О2
(1) 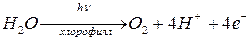
Эта реакция – 1-ый этап фотосинтеза, требующий освещения.
Второй процесс (темновая) стадия синтеза органического вещества – восстановление СО2 до уровня глюкозы
(2) 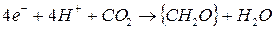
Суммарная реакция:
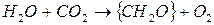 , где под
, где под 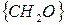 подразумевается 1/6 часть глюкозы.
подразумевается 1/6 часть глюкозы.
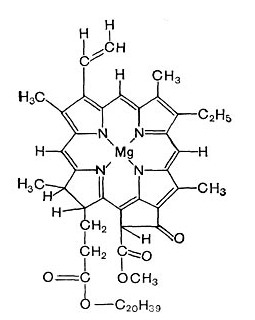
Фотосинтез протекает во фрагментах клетки, которые называются хлоропласты – в их структурах содержаться фотосинтетические пигменты, основным из которых является хлорофилл.
Хлорофилл представляет собой порфириновую систему, основой которой является пиррольный цикл.
Механизм фотосинтеза имеет сложную природу и еще до конца не ясен. В общем виде механизм выглядит следующим образом:
При поглощении солнечного излучения (хлорофилл поглощает главным образом синий – 450 нм и красный 650 нм свет) молекулы Chl переходят в возбужденное состояние:
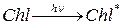
Энергия возбуждения по цепи сопряжения передается в реакционный центр хлоропласта (включающий до 300 молекул пигмента). В реакционных центрах образуются катион-радикалы димера хлоропласта (Chl2+), лоторые окисляют воду в 4-х электронном процессе (реакция 1) (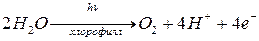 ). Т.е. энергия активированных молекул хлорофилла расходуется на окисление воды до О2 и восстановление СО2.
). Т.е. энергия активированных молекул хлорофилла расходуется на окисление воды до О2 и восстановление СО2.
Важную роль при это играет, как полагают, Mn, который является непосредственным окислителем.
Формальная схема фотокаталитического окисления воды выглядит следующим образом:
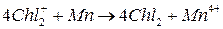
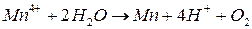
Первоначально Mn окисляется катион-радикалом димера Chl2+ , затем Mn4+ непосредственно окисляет воду.
Скорость фотосинтеза (R) зависит от интенсивности света. Влияние этого фактора отражает следующая зависимость:
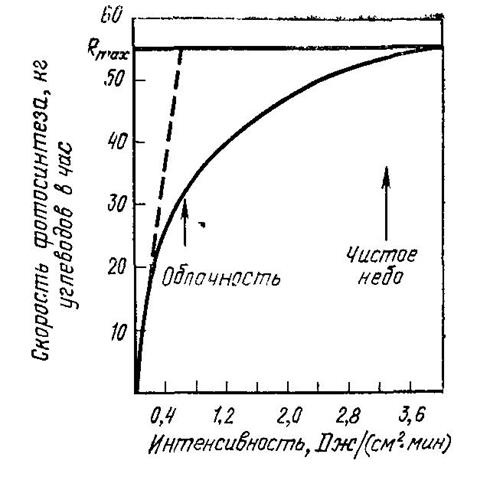
В темноте скорость фотосинтеза = 0, затем по мере увеличения интенсивности R возрастает линейно и затем форм зависимости меняется и при некоторой интенсивности R достигает максимального значения (Rmax), величина которого зависит от соотношения парциальных давлений 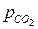 и
и 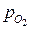 в атмосфере. В ясный день интенсивность света может достигать 3, 3дж/см2мин, что обеспечивает максимальную скорость фотосинтеза (Rmax). В пасмурный день освещенность может снижаться примерно в 5 раз, а скорость фотосинтеза лишь наполовину.
в атмосфере. В ясный день интенсивность света может достигать 3, 3дж/см2мин, что обеспечивает максимальную скорость фотосинтеза (Rmax). В пасмурный день освещенность может снижаться примерно в 5 раз, а скорость фотосинтеза лишь наполовину.
Как видно из представленной зависимости, чтобы вызвать существенное изменение скорости фотосинтеза и соответственно снижение количества поступающего в атмосферу кислорода, нужно очень существенное уменьшение интенсивности света. Такой случай по естественным причинам маловероятен (разве что какая либо гипотетическая катастрофа типа падения на Землю гигантского астероида, взрыв которого в плотных слоях атмосферы) мог бы вызвать образование мощных пылевых облаков над всей территорией Земли. Аналогичные катастрофические последствия могла бы вызвать глобальная ядерная война.
Существенную угрозу для фотосинтеза представляет розливы нефти и нефтепродуктов в мировом океане. Как отмечалось, очень важную роль в снабжении атмосферы кислородом играет фитопланктон. При разливах нефтепродуктов образуется такая углеводородная пленка на поверхности воды, препятствующая газообмену с атмосферой и естественно нарушающая процесс фотосинтеза. На баланс О2 в атмосфере в определенной степени может влиять сельскохозяйственная деятельность, а именно распашка земель, занимаемых лесами, т.е. уменьшение площадей, занимаемой фотосинтезирующей наземной растительностью (и аналогичные по последствия действия).
Однако в настоящее время нет непосредственных признаков нарушения цикла кислорода. Запасы кислорода достаточно велики: на 1 м2 земной поверхности приходится около 60000 моль О2, расход на дыхание всего 8 моль/1 м2 поверхности в год. Если мы сожжем все известные запасы ископаемого топлива, то используем всего лишь 3% имеющегося О2. Проблемы могут возникнуть из-за тех последствий антропогенной деятельности, которая сопровождается уничтожение лесов, разрушение почвенного покрова, гибели фитопланктона из-за загрязнения океанических вод нефтепродуктами.
Круговорот азота
Азот в той или иной форме присутствует во всей биосфере. Это важнейший биогенный элемент, входящий в состав биомолекул живых организмов – белков (где его доля до 16-18%), нуклеиновых кислот, хлорофилла, гемоглобина. Азот – основной компонент биосферы (его содержание ~ 79 %) В гидросфере содержание азота во всех химических формах в среднем 5*10-5 моль/л.
Газообразный N2 служит основным резервом для круговорота азота. При этом в глобальном биогеохимическом цикле азота ведущая роль принадлежит массообмену между атмосферой и почвой, где азот связан с живым органическим веществом, органическим остатком или гумусом. Большинство биологических форм не усваивает молекулярный азот, для того чтобы свободный азот атмосферы мог быть использован в биологических процессах, он должен быть превращен в органические (карбамид, аминокислоты, белки) или неорганические соединения (NH3, аммонийные соли, нитраты), т.е. химически связан в какие то соединения. Это химическое связывание (фиксация) возможно физико-химическим способом (1) либо биологически путем (2) причем биологический способ играет главную роль в вовлечении свободного азота в круговорот.
1) небиологическая фиксация N2 (N  N) в естественных условиях происходит:
N) в естественных условиях происходит:
а) в основном при электрических разрядах в атмосфере. Электрический разряд инициирует распад молекулы N2 на атомы (это происходит в само канале молнии где температура достигает тысячи градусов)
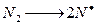
и ряд последующих процессов, приводящих к образованию оксидов азота.
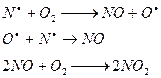
технические процессы:
б) Образование оксидов азота из азота воздуха происходит так же в технологических процессах при высоких температурах (в двигателях внутреннего сгорания, при сжигании топлива)
в) еще один химический способ связывания азота – целенаправленный технический процесс производства NH3 при взаимодействии N2 и H2, широко используемый в промышленности азотных удобрений
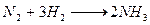
2) Биологический путь фиксации молекулярного азота – химическое связывание так называемыми клубеньковыми бактериями, свободно обитающими либо симбиотически связанными с некоторыми видами растений, обитающими в корнях некоторых наземных растений семейства бобовых (клевер, горох, люцерна и т.д.), а в гидросфере – сине-зелеными водорослями (известно что растения семейства бобовых значительно обогащают почву легкоусваиваимыми соединениями азота – клевер например дает до 150 кг связанного азота в год)
Фиксация азота клубеньковыми бактериями – восстановительный ферментативный процесс, катализатором которого служит фермент нитрогеназа, содержащийся в клетках бактерий. Нитрогеназа – сложный белковый комплекс из 2-х белков (ММ=230 тыс. и 60 тыс.) в состав которого входят атомы Мо и Fe
Фиксация осуществляется по схеме:
|
|
|
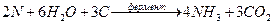
 |
Переносчикам электронов в окислительно-восстановительном процессе являются атомы Мо и Fe, легко меняющие степени окисления.
В результате фиксации растения получают азот в доступной для них форме. Другой вид автотрофных бактерий (автотрофы – синтезирующие их простых неорганических соединений сложные органические) способен окислять азот в аммиаке – осуществлять процесс нитрификации (образование нитритов и нитратов) - то происходит довольно быстро в почвах и водных экосистемах
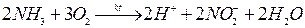 - процесс при участии бактерий – нитрозомоназ и нитробактер
- процесс при участии бактерий – нитрозомоназ и нитробактер
 - бактерии азобактер
- бактерии азобактер
Связанный азот в аммонийной и или нитратной форме усваивается растениями и используется в синтезе азотсодержащих органических соединений - аминокислот (структурные единицы белков) и белков растений (причем аммонийный азот является предпочтительной формой доступного азота)
Растительные белки служат пищей для животных, в организме которых они превращаются в живые белки, либо выводятся из организма.
После гибели организма бактерии (микроорганизмы) других типом
В могут расщеплять белки до аминокислот и преобразовывать азот, входящий в состав аминокислот, в NH3 в результате процесса аммонификации - составная часть цикла.
Пример – микробиологическое разрушение глицина
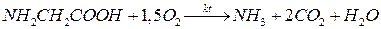
При этом NH3 (а в кислой среде ион NH4+) возвращается в цикл, помогая восстановлению равновесия (в балансе азота)
Кроме того в природе постоянно протекают процессы денитрификации – преобразование NO2- или NO3- в газообразный азот (преимущественно) или N2O, выделяющийся по схеме.
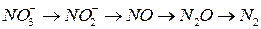
Эти процессы под действие динитрифицирущих бактерий и распространены в почвах и водных системах с низким содержанием кислорода, т.е. в анаэробном окружении.
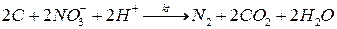 - в этих условиях безазотные органические вещества окисляются за счет нитратов и нитритов. Последние восстанавливаются до газообразного азота
- в этих условиях безазотные органические вещества окисляются за счет нитратов и нитритов. Последние восстанавливаются до газообразного азота
Процессы денитрификации являются важными составными частями круговорота азота – они завершают круговорот возвращая в него фиксированный ранее азот. Таким образом при нормальных условиях полное количествоо фиксированного азота, возвращенного в окружающею среду равно полному количеству газообразного азота, возвращенного в окружающую среду
Схема цикла азота в биосфере может быть представлена следующей схемой:

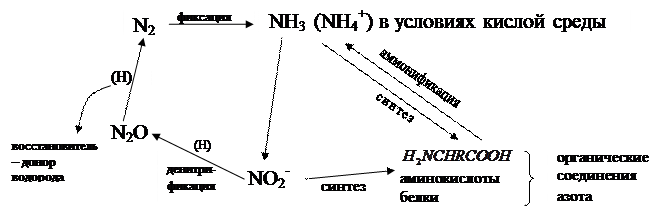
Естественный круговорот азота характеризуется очень малой скоростью и сильно подвергается антропогенному воздействию. Оно состоит в значительном (во включении в цикл больших количеств) пополнении цикла азота прежде всего неорганических соединений азота в нитратной и аммонийной формах за счет использования азотных минеральных удобрений – искусственно синтезированных или извлеченных из природных залежей (азот, который выключен из круговорота)
Для обеспечения урожайности сельскохозяйственных культур ежегодно в почву в мире вносится около 35 млн. т. азота с минеральными удобрениями. В силу высокой подвижности (и слабой удерживаемости почвой) азот в нитратной форме легко вымывается из почв и выносится в водоемы.
Значительное количество азота поступает в окружающую среду (в почву, воду) с коммунально-бытовыми, производственными отходами, отходами животноводства
При сложившейся антропогенной нагрузке на азотный цикл деятельность денитрифицирующих бактерий отстает от темпов поступления азота в окружающую среду и в результате наблюдается накопление нитратов и промежуточных продуктов в окружающей среде, сопровождающееся загрязнением питьевой воды, почв, эвтрофикацией водоемов.
Круговорот Фосфора
Наличие фосфора (вместе с азотом) удовлетворяет основные потребности живых организмов в питательных веществах.
Круговорот фосфора проще чем азота и охватывает только литосферу и гидросферу. Газообразные соединения фосфора практически полностью отсутствуют в круговороте. Основным резервуаром фосфора являются горные породы и отложения, образовавшиеся в прошлые геологические эпохи. При этом водная систем является конечным пунктом его движения, которое таким образом в течение небольших отрезков времени – десятков-сотен лет – является односторонним с суши в воду и далее в донные отложения. Т.е. создается впечатление отсутствия цикличности в перемещении фосфора, она проявляется в масштабах геологического времени – миллионов лет
Естественное включение фосфора в круговорот происходит в результате выветривания иди другого нарушения фосфотических пород с последующи растворение соединений фосфора почвенной влагой которая доносит фосфор до корней растений. Антропогенный путь включения фосфора в цикл – внесение фосфатных минеральных удобрений. При этом основной способ получения соединений фосфора промышленным способом – апатит 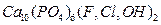 , фосфорит -
, фосфорит - 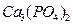 (+ вторичное фосфорсодержащее сырье, шлаки, другие отходы)
(+ вторичное фосфорсодержащее сырье, шлаки, другие отходы)
Фосфор играет исключительно важную роль в биологических системах. Он в виде остатка фосфорной кислоты входит в состав молекул нуклеиновых кислот РНК и ДНК, ответственных за биосистему белков и передачу наследственной информации.
Скелет молекулы нуклеиновой кислоты – полиэфирная (точнее нуклеотидная) цепь, в которой сложноэфирная связь образуется между фосфорной кислотой и молекулой углевода (сахаром). В общем виде структура нуклеиновой кислоты выглядит след образом

В РНК – углеводный фрагмент Д-рибоза (пяти атомарный углевод) в фуранозной (циклической) форме:
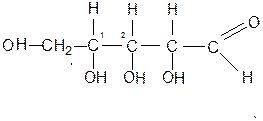
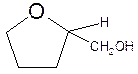
Фосфор входит в состав АТФ (аденозинтрифосфосфата) и АДФ [аденозиндифосфата], который выполняет многие важные функции и биологических системах
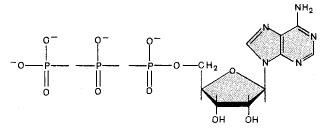
АТФ активирует биохимические реакции (осуществляя фосфорилирование на промежуточных стадиях биохимсинтеза); при помощи АТФ запасается необходимая для биохимпроцессов, протекающих в организме, энергия.
Выделение энергии происходит при гидролизе АТФ, сопровождающаяся разрывом связи Р—О—Р концевой фосфатной группы
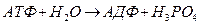
При этом освобождается энергия ~12 ккал/моль
В силу важнейшей роли фосфора в биологических процессах его нехватка с окружающей среде может быть фактором, лимитирующим процессы жизнедеятельности (это, кстати, имеет место во многих почвах, так как фосфаты встречаются в определенных типах пород) подобное явление имеет место в океанах – в мировом океане растворено определенное количество фосфора, главным образом – в глубинных слоях, куда не проникает свет и где фосфор не может ассимилироваться (усваиваться) водорослями, таким образом центральная роль океанов малопродуктивна, но в зонах где воды обогащены фосфором и есть свет биопродуктивность высока.

 Упрощенная схема круговорота фосфора
Упрощенная схема круговорота фосфора
В конце жизненного цикла фосфор в виде неорганического фосфата возвращается в систему замыкая круговорот.
Выводится из круговорота фосфор в основном путем осаждения в форме нерастворимых фосфатов железа в водной среде, накапливаясь в глубоководных донных осадках.
Вмешательство человека в круговорот фосфора проявляется в основном в увеличении избытка фосфат-ионов в водных системах при поступлении в них смытых с полей фосфорных удобрений, неочищенных коммунально-бытовых сточных вод, в состав которых входят фосфорсодержащие моющие вещества (полифосфаты – компоненты многих ПАВ). Избыток же фосфора в воде, ак и избыток азота способствует эвтрофикации водоемов.
Круговорот серы
Круговорот серы в окружающей среде сложен и до конца не прояснен. В природе сера встречается в виде самородной серы, но в основном в виде сульфидных и сульфатных минералов (FeS2, CuFeS2, CaSO4*2H2O и др.) т.е. преимущественно в СО -2 и +6. И в виде такого же типа минеральных примесей в твердых горючих ископаемых (уголь, горючие сланцы), в виде сульфатных солей и кроме того в виде Н2S – сопутствующего компонента природного газа некоторых месторождений. В природных круговорот включается сера из природных источников и в результате деятельности человека.
Из природных источников сера попадает в атмосферу в виде:
· H2S (извержение вулканов, разложение органического вещества в болотах);
· SO2 (извержение вулканов)
· Аэрозольных частиц сульфатных солей (испарение брызг морской воды)
· (СH3)2S - продуцирование микроорганизмами (микроводоросли и высшие растения)
H2S быстро окисляется в атмосфере до SO2 (среднее время жизни H2S в атмосфере 2 сут.) тоже самое происходит и с диметилсульфидом.
Примерно 1/3 всех соединений серы и 99% SO2, поступающих в окружающую среду, имеют антропогенное происхождение (сжигание серосодержащего топлива, цветная металлургия, производство серной кислоты)
SO2 в среднем живет в атмосфере около 4 суток. он окисляется до SO3 и взаимодействуя с водой образует H2SO4, является причиной выпадения кислотных дождей
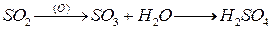
H2SO4 источник образования сульфатов, сульфаты поступают в почву или выносятся накапливаясь в конечном итоге в морских водах.
Сера является жизненно важным элементом. Она входит в состав 2-х аминокислот (метионина 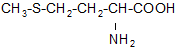 - незаменимая и цистеина
- незаменимая и цистеина 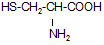 ), т.е. включена в структуру некоторых белков.
), т.е. включена в структуру некоторых белков.
Биосферный круговорот серы базируется на 2-х типах процессов
Основной тип процессов в биосфере, затрагивающих соединения серы – окислительные
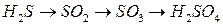 (фотохимические процессы)
(фотохимические процессы)
Химические и фотохимические процессы при доступе воздуха
В аэробных условиях сульфидные минералы достаточно легко окислятся до сульфатов и H2SO4 кислородом воздуха
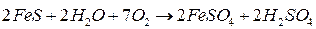
Восстановительные процессы, в которых участвуют соединения серы это в основном биохимические процессы.
В частности сера сульфатов, задерживающихся в почве, извлекается растениями и в результате биохимических превращений включается в состав белков (в тиольной группе, для большой группы микроорганизмов 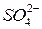 заменяет O2 в качестве акцептора электронов при окислении органических соединений)
заменяет O2 в качестве акцептора электронов при окислении органических соединений)
Далее стандартная цепочка
растительный белок → животный белок → микробиологические разложение в анаэробных условиях → H2S (H2S вновь включается в круговорот)
Таким образом основной биогенный компонент (продукт биохимических реакций) - H2S. Наряду с ним в атмосферу выделяется (СH3)2S – образующийся в анаэробных условиях в результате жизнедеятельности ряда микроорганизмов в почве и некоторых высших растений, а так же морских микроорганизмов (продуцируется ими)
В упрощенном виде цикл серы в окружающей среде можно представить схемой


Особенность круговорота серы состоит в том, что восстановительные процессы не компенсируют окислительные, поскольку сульфидные соединения при контакте с воздухом и водой постоянно окисляются в сульфаты.
Точно так же и в антропогенных процессах природные сульфиды переводятся в сульфаты. Т.е. цикл превращений серы не просто круговорот, а кроме того - поступательный процесс, развивающийся в направлении перехода серы от одних устойчивых форм в другие (и.е. от более устойчивых в прежних исторических условиях сульфидов к более устойчивым в современных устойчивых сульфатам). При этом в современных период этот переход дополнительно ускорятся антропогенной деятельностью, приводящей к образованию и накоплению в биосфере продуктов окислительных процессов SO2 (и H2SO4), нарушающих жизнедеятельность лесных и водных экосистем.
В качестве итога к рассмотренным круговоротам веществ можно отметить следующее
Природные круговороты биогенных веществ имеют достаточно высокую степень замкнутости. Протоки биогенных элементов внутри круговоротов существенно превышают по величине потоки вещества в биосфере из внешних источников. Это очень важно, поскольку именно этот факт определяет устойчивость биосферы.
Дело в том что при замкнутости потока вещества из вне в биосфере могут сформироваться «ущербные экосистемы», включающие ограниченное число видов живых организмов (по существу потребители), н образующие экологические сообщества. Т.н. отдельные экосистемы буду деградировать и не будут стремится к развитию и поддержания разнообразия внутри них («работать не надо, всех долой, а что случись…»)
Это естественно несет опасность для разнообразия и устойчивости биосферы в целом, поскольку устойчивость прямо связана с разнообразием – как уже отмечалось, биосфера сложная система, а есть общее правило, которому подчиняются сложные системы, чем выше их внутреннее разнообразие, тем они устойчивее, тем в более сложджных условиях они способны существовать.
На разнообразие в биосфере (как условие поддержания ее устойчивости) оказывает влияние так же величина запасов в биосфере биогенных веществ в органической и неорганической фрмах, которые в принципе д.б. ограниченны и совпадать по порядку величины для того чтобы потоки веществ в процессах синтеза и разложения биосферой были уравновешены.
Основная опасность вмешательства человека в круговороты как раз и состоит в нарушении установившегося соотношения между величинами потоков веществ внутри круговоротов и внешних потоков.
Переходим к вопросам поведения химических веществ в окружающей среде
Закономерности распространения химических веществ в природные среде
Закономерности распространения химических веществ – одни из ключевых вопросов науки «ХОС» поскольку перемещение химических веществ от источника выброса и переход из одной среды в другую (миграция) главный фактор, обуславливающий химической загрязнение ОС (изменение ее состава и свойств). Химические загрязнения определяются так же и трансформацией веществ их первоначального состояния в другие формы под воздействием различных причин, но все же главный фактор – миграция.
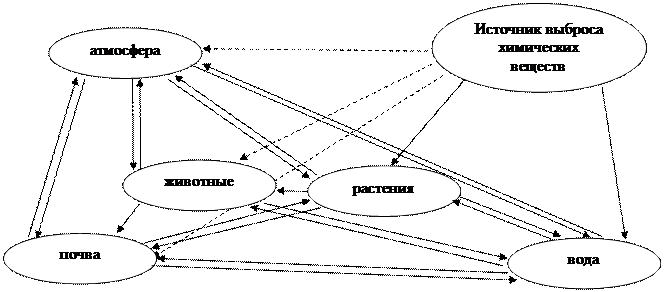 Пути распространения веществ в окружающей среде в общем виде можно представить схемой:
Пути распространения веществ в окружающей среде в общем виде можно представить схемой:
От источника выброса химические вещества поступает в одну из сред, либо непосредственно в растительные организмы (ядохимикаты), из которых по пищевой цепи передается в животные организмы. Возможны также взаимные переходы химических веществ между каждой из сред.
Попадая в окружающую среду (в какую то часть) вещества могут мигрировать в пределах одной среды (геосферы) и также перемещаться через межфазные границы и переходить в другую среду.
Что влияет на процессы миграции в каждом случае и каковы эти процессы?
I. В пределах одной среды
- в водной среде – вещество может перемещаться будучи:
· в растворимом состоянии
· адсорбированном на поверхности взвешенных частиц.
Это перемещение (направление, скорость и т.п.) очевидно будет определятся гидрологическими параметрами.
- в атмосфере вещества могут находится в виде паров или сорбированном на частицах пыли.
Перемещение веществ в атмосфере определяется в таком случае метеорологическими параметрами (атмосферными течениями, зависящими от метеоусловий – распределение температуры, давлением в атмосфере, влажностью и т.п.)
- в почве - миграция несколько отличается от водной и воздушной сред – она осуществляется главным образом в результате диффузии в водной фазе почвы: с другой стороны частицы почвы сами могут перемещаться в атмосфере или воде, перенося сорбированные вещества - в этом случае перенос определяется теми же факторами, которые определяют движение воздуха или воды.
Кроме того играет роль конвективный массоперенос
Характер миграции (скорость, направление перемещения) ожжет измениться в результате трансформации вещества - перехода в другие химические формы под действием внешних условий. Например, в водной среде, почве большое влияние на поведение веществ оказывают кислотно-основные и окислительно-восстановительные условия, влияющие на растворимость вещества. Но если не принимать во внимание возможную трансформацию, то можно сделать вывод, что миграция конкретного в пределах одной среды определяется главным образом характеристиками переноса и физико-химическими условиями в данной среде. Влияние характеристик переносимого вещества при это незначительно.
II. Перемещение между сферами (через межфазные границы)
В этом случае основное значение имеют физико-химические свойства вещества (прежде всего те, которые определяют установление межфазного равновесия).
Коротко о процессах, определяющих межфазные переходы и основных факторах, которые имеют значение при определении возможности перемещения вещества через различные поверхности раздела фаз.
1. вода ↔ почва – перемещение через эту границу раздела играет важную роль, например, в процессе загрязнения вод в результате применения химических препаратов на сельскохозяйственных землях (которые затем вымываются из почвы дождями), а так же в процессе загрязнения почв, контактирующих с загрязненными водами.
Для всех переходов химических веществ через границу вода почва основную роль играет адсорбционно-десорбционные процессы (протекающие по различным механизмам – физическая адсорбция, хемосорбция). Таким образом этот переход по существу процесс адсорбции-десорбции. Это равновесные процессы ________ которых зависит от:
· растворимости вещества в воде;
· от свойств вещества, определяющих адсорбцию на твердой поверхности
2. вода ↔ воздух
Переход вещества из водного раствора в воздух – испарение – осуществляется в результате диффузии. Обратный процесс называется сухое осаждение в воду. Оба этих процесса относятся к динамическим (а не равновесным), имеют одинаковые закономерности, но противоположно направленные. На границе раздела фаз вода-воздух имеют значение прежде всего:
·
|
 давление насыщенных паров вещества
давление насыщенных паров вещества
· растворимость его в воде
3. почва ↔ воздух.
Переход из почвы в атмосферу – испарение из почвы, обратный переход – сухое осаждение в почву.
Миграционные процессы между этими средами наиболее сложны в силу сложности строения почвы. Почва – многофазная система, включая твердую фазу, жидкую и газообразную фазу. В свою очередь твердая фаза так же по химическому составу неоднородна и состоит из органических и минеральных составляющих. Таки образо здесь большое значение имеют обменные процессы ж/ТВ фаза, ж/газ, тв. фаза/газ.
Очевидно перенос вещества между средами почва ↔ воздух зависит:
· от свойств вещества, определяющих адсорбцию на часицах почвы
· давление насыщенных паров
· присутствие воды в почве, которая влияет на перемещение вещества на границе раздела фаз
4. физическая система ↔ биологическая система
граница раздела между этими системами существенно отличается от рассматриваемых систем. Здесь вещество, проникая в организм, проходит через биологическую (клеточную) мембрану, структура которой играет главную роль в переносе.
Геохимические барьеры
Миграция вещества в окружающей среде может привести в конечном итоге к его рассеянию или накоплению. Накопление вещества происходит в так называемых геохимических барьерах.
Геохимические барьеры – участки (части) биосферы, где происходит резкое замедление скорости миграции и, соответственно, накопление вещества, удерживание токсичных химических веществ в геохимических барьерах очищает потоки вещества и ограничивает сферу загрязнения.
Геохимические барьеры биосферы разделяет на 2 основных типа:
· Природные
· техногеные
Те и другие разделяются на участках изменения геохимической обстановки. В случае природных барьеров смена геохимической обстановки обусловлена природными особенностями конкретного участка биосферы, где формируется барьер. Техногенный барьер возникает при смене геохимической обстановки в результате антропогенной деятельности.
Оба типа барьеров разделяют на 3 класса:
· биогеохимические
· механические
· физико-химические.
Биогеохимические – возникают при интенсивном закреплении химических веществ живыми организмами. Примером биогеохимического барьера может быть накопление в высоких концентрациях сельскохозяйственными культурами веществ, используемых при отработке сельскохозяйственных земель. Обычно такое накопление происходит при внесении чрезмерных доз удобрений или ядохимикатов (средств защиты растений).
Механические барьеры – участки с резким уменьшением интенсивности механического перемещения химических веществ. Они возникают при изменении скорости воздушных или водных потоков, например, при изменении направления русла реки, при наличии плотины на реке.
Механический барьер может возникнуть вследствие фильтрационного эффекта – таким барьером могут быть пористые породы. Механическим барьером для дисперсных частиц в приземном слое атмосферы являются лесополосы, на которых откладывается, большое количество пыли, выдуваемой из почв при обработке сельскохозяйственных земель.
Физико-химические барьеры – возникают при изменении физико-химических условий среды, в которой перемещается вещество. В них подвижность веществ уменьшается за счет, например, адсорбция, изменение степени окисления, образование гидроксидов (или др. нерастворимых форм) и т.п.
Распространенным типом физико-химических барьеров является щелочные барьеры в роли которых выступают карбонатные породы, концентрирующие многие элементы. Примером техногенного физико-химического барьера могу служить часто встречающие сероводородные барьеры. Они формируются в водных объектах при наличии сульфат-ионов в воде и поступление значительного количества органических веществ, например, со сточными водами населенных пунктов. Органические вещества, разлагаясь, поглощают растворенный в воде свободный кислород, так что формируются анаэробные условия и в роли окислителя выступает ион SO42- При этом сульфатная сера (S6+) восстанавливается до сульфидной, а сульфид-ион связывает многие элементы (сульфиды большинства металлов нерастворимы). Это ведет к остановке миграции элементов в водной среде и их накопление в таком сероводородном барьере.
Геохимические барьеры не остаются неизменными. По мере накопления на барьерах различных веществ возможно разрушение исходных и образование новых барьеров. Например, карбонатные породы литосферы могут являться барьером для миграции Са2+ - в них Са закрепляется, образуется нерастворимый кальцит СаСО3 Но далее кальцит выступает как щелочной карбонатный барьер для многих элементов: Pb, Zn, Cd и др.
Геохимические барьеры обладают определенной емкостью по отношению к отдельным веществам, например емкость щелочного барьера в почвах определяется количеством карбонатов, способных нейтрализовать кислые техногенные потоки. Емкость сорбционного барьера зависит от свойств и мощности сорбирующего слоя. Емкость восстановительного и окислительного барьеров зависят от окислительно-восстановительных свойств среды (которые в значительной мере определяются микробиологической активностью).
Химической загрязнение окружающей среды главным образом определяется возможностью перемещения (миграции) химических веществ от источника выброса на значительные расстояния. Вещества могут распространятся в пределах одной среды, куда они поступают, но могут переходить и в другие среды, распространяясь в них. Перемещение веществ в окружающей среде происходит главным образом в результате процессов испарения, адсорбции, диффузии. При этом миграционная способность веществ зависит от ряда физико-химических свойств.
Приведем общую характеристику некоторых из этих свойств, определяющих перемещение веществ в окружающей среде и процессов миграции.
|
|