
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Физико-химические свойства, определяющие перемещение веществ в окружающей среде
|
|
В наибольшей степени на миграцию влияют:
· равновесное давление паров
· растворимость
· гидрофобность (гидрофильность)
· кислотно-основные свойства
1. равновесное давление паров
давление паров жидкого или твердого вещества в воздухе, находящихся в равновесии с жидким или твердым веществом при данной температуре (т.е. давление насыщенных паров (ДНП) при данной температуре).
Эта величина определяет летучесть веществ, т.е. способность переходить из жидкой или твердой фазы в газообразную. Равновесное давление паров зависит от температуры. Эта зависимость описывается термодинамическим уравнением Клазиуса-Клапейрона:

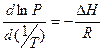
где Т – абсолютная температура
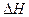 - теплота испарения
- теплота испарения
R – универсальная газовая постоянная (8, 31 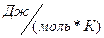 )
)
В практике для расчет равновесий широко используется эмпирическое уравнение Антуана, связывающее равновесное давление и температуру. Его:
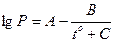 ,
,
где to - температура в градусах Цельсия
А, В, С – константы конкретного вещества для данного температурного интервала
В справочной литературе в соответствующих таблицах можно найти значение констант для очень многих веществ.
Равновесное давление паров является важным фактором распространения веществ в объектах окружающей среды, причем не только легко летучих, но при определенных обстоятельствах и твердых при нормальных условиях низколетучих веществ (например, из группы ядохимикатов – их давление паров мало, но при обработке больших площадей поступление в воздух этих веществ значительные).
2. Растворимость (в воде)
Свойство определяющее способность веществ переходить в водный раствор. Растворимость играет важную роль в процессе перемещения веществ практически через межфазные границы, а так же миграции в водной среде и почве.
Растворимость твердых веществ характеризуется концентрацией насыщенного раствора, которая соответствует концентрации растворенного вещества, находящегося в равновесии с избытком твердого вещества при данной температуре.
Характеристика растворимости летучих веществ и газов является константа Генри (Кн), представляющая собой соотношение равновесных концентраций вещества в жидкой и газовой фазах. В КН для описания концентрации вещества в газовой фазе используется давление, соответствующее равновесной концентрации, таким образом константа Генри:
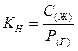
обычно размерность 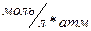
т.е. при равенстве скоростей перехода молекул из газовой фазы в жидкую и обратно 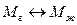
(очевидно, чем больше КН тем бОльшую растворимость имеет вещество)
Константа Генри, как и концентрация насыщенного раствора (обратно пропорциональная величина) зависит от температуры, но эта зависимость противоположная (чем выше температура тем ниже константа Генри)
Растворимость многих веществ и соответственно миграционная способность (подвижность) зависят от внешних факторов, которые могу повлиять:
· либо на величину показателя растворимости (таким фактором, например, является температура)
· либо на трансформацию вещества.
Например, многие элементы при изменении степени окисления под влиянием внешней среды могут образовывать растворимые легкомигрирующие вещества. То же самое можете иметь место и в результате комплексообразвоания.
3. Гидрофобность (гидрофильность)
Характеризуется показателем «коэффициент распределения» Химические вещества в системе [вода/органическая жидкость, несмешиваемая с водой]
КР – важнейшая характеристика вещества, использующаяся как мера полярности молекул вещества
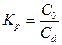 - отношение равновесной концентрации вещества в двух, контактирующих фазах: неводной (равновесная концентрация в числителе) и водной (равновесная концентрация в знаменателе)
- отношение равновесной концентрации вещества в двух, контактирующих фазах: неводной (равновесная концентрация в числителе) и водной (равновесная концентрация в знаменателе)
Это величина постоянна при отсутствии в системе заметного взаимодействия между молекулами растворенного вещества или между растворенным веществом и растворителем, которое могло бы повлиять на процесс распределения.
На величину КР оказывает влияние другие процессы, протекающие в системе. Простой пример – распределение органической кислоты между водой и органической фазой (бензол). В этом случае в водной фазе кислота диссоциирует: 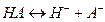 а в неводной ассоциирует образуя димер:
а в неводной ассоциирует образуя димер:
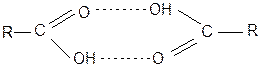
При этом очевидно значительное влияние на величину КР будет оказывать рН водной среды, определяющее соотношение молекулярной и ионизированной форм/
 Коэффициент распределения – очень важная характеристика, являющаяся обобщенным свойством молекул вещества. Эта константа в частности играет важную роль в процессах переноса физическая система биологическая система. По величине коэффициента распределения можно судить о способности вещества проникать из-вне в биологические системы – о липофильности вещества.
Коэффициент распределения – очень важная характеристика, являющаяся обобщенным свойством молекул вещества. Эта константа в частности играет важную роль в процессах переноса физическая система биологическая система. По величине коэффициента распределения можно судить о способности вещества проникать из-вне в биологические системы – о липофильности вещества.
Коэффициент распределения находится экспериментально и отражается в справочной литературе. Для определения (оценки) поведения веществ в окружающей среде обычно используют значение коэффициента распределения для систем вода/углеводород (гексан, циклогексан, октан) либо вода/н-октанол.
4. рК – показатель константы кислотности или основности
Многочисленную группу химических веществ, попадающих в окружающую среду составляют органические кислоты и основания, которые относятся к слабым кислотам или основаниям и могут находиться в среде в молекулярной или ионизированной форме. Для оценки поведения и возможностей распространения вещества в окружающей среде необходимо оценивать преобладающую форму данного вещества, которая связана со степенью диссоциации молекул.
Количество диссоциированных молекул (степень диссоциации) является рК конкретного соединения и рН среды, в которой они находятся. Проанализируем эту зависимость.
Слабая кислота диссоциирует по реакции:
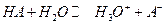
 | |||
 | |||
Для сопряженного основания равновесие: 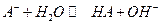
Константа равновесия (кислотности) Ка определяется как:
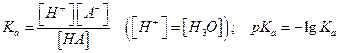
рН и рКа связаны уравнением 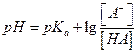 - уравнение Гендерсона-Хассельбаха (это уравнение используется для расчета составляющих буферных расворов, в которых рН – зависимая переменная, а [A-] и [HA] можно регулировать)
- уравнение Гендерсона-Хассельбаха (это уравнение используется для расчета составляющих буферных расворов, в которых рН – зависимая переменная, а [A-] и [HA] можно регулировать)
при рассмотрении ситуации, связанной с загрязнением окружающей среды необходимо знать [A-] и [HA] (состояние диссоциированной и недиссоциированной форм)
Эти концентрации можно выразить в виде функции рН и рК: 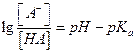
Если общая концентрация вещества (А) равна 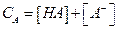 , то (подставив в уравнение Ка получим):
, то (подставив в уравнение Ка получим): 
Измененяя концентрации [HA] и [A-] при изменении рН среды при некоторой определенной концентрации СА вещество с известным значением рКа выглядит следующим образом:

|
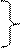 До значений рН=рКа кислота находится преимущественно в молекулярной форме (избыток Н+ сдвигает равновесие влево), при больших – в ионизированных, т.е. (для карбоновой кислоты):
До значений рН=рКа кислота находится преимущественно в молекулярной форме (избыток Н+ сдвигает равновесие влево), при больших – в ионизированных, т.е. (для карбоновой кислоты):
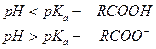
Аналогично можно показать зависимость преимущественной формы присутствия в окружающей среде оснований. В общем случае диссоциация основания идет по уравнению:
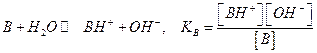
Часто задается константа кислотности для кислоты, сопряженной с данным основанием для равновесия:
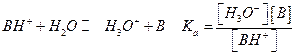
В этом случае Ка и Кв связаны между собой  (константа для воды Kw=10-14) или
(константа для воды Kw=10-14) или 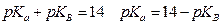
|
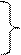 Тогда по аналогии: при
Тогда по аналогии: при 
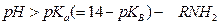
Переход одной формы в другую в основном происходит в диапазоне изменения pH ~ на 3 единицы от значения pH=pK (в обе стороны)
|
|