
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Межа застосування класичної механіки
|
|
Спеціальна теорія відносності внесла фундаментальні зміни в закони класичної механіки, виходячи з таких постулатів
· всі інерційні системи відліку є рівноправними;
· швидкість світла в усіх інерційних системах є однаковою.
З цих постулатів випливає, що швидкість світла є максимально допустимою в природі. Будь-який матеріальний об'єкт не може рухатися швидше за світло.
З точки зору спеціальної теорії відносності простір і час тісно пов'язані між собою. Їх слід вважати єдиним чотиривимірним многовидом, що має назву „простір-час”. Спостерігачі, що рухаються один відносно одного, по-різному визначають " просторові" і " часовий" напрямки у цьому многовиді. Тому простір і час більше неможливо розглядати як дві окремі сутності.
Загальна теорія відносності доповнила цю картину тим, що енергія гравітаційного поля (породжена матерією) здатна деформувати простір-час так, що „прямі” лінії в просторі та часі мають властивості „кривих” ліній.
Теорія відносності входить в істотне протиріччя з деякими аспектами класичної механіки. Наприклад, парадокс Еренфеста показує несумісність СТО з поняттям абсолютно твердого тіла. Треба відзначити, що навіть у класичній фізиці передбачається, що механічне вплив на тверде тіло поширюється зі швидкістю звуку, а аж ніяк не з нескінченної (як має бути в уявній абсолютно твердої середовищі).
Механі́ чні колива́ ння — це фізичний процес у механіці, під час якого чергуються інтервали збільшення і зменшення фізичної величини.
Бувають прості і складні. Складні коливання- це певним чином скомбіновані прості. Вони найчастіше спостерігаються в живих організмах. Прості коливання в свою чергу поділяються на:
а) гармонічні коливання — такі коливання, які відбуваються за законом синуса або косинуса;
б) Реальні (згасаючі) коливання — ті коливання, що мають місце в природі, поступово згасають;
в) вимушені коливання — відбуваються при дії на систему зовнішньої сили, яка повинна діяти ритмічно (за законом гармонічних коливань).
Математичний маятник — теоретична модель маятника, в якій матеріальна точка масою m підвішена на невагомому нерозтяжному стержні довжини l і здійснює рух в вертикальній площині під впливом сил тяжіння з прискоренням вільного падіння g.
Фізи́ чний ма́ ятник — тверде тіло довільної форми, яке під дією сили тяжіння здійснює коливання навколо нерухомої горизонтальної осі, що не проходить через центр маси тіла.
Рух фізичного маятника складний. У загальному випадку його можна розділити на коливання і обертання центра маси щодо вісі і власне обертання.
Пружинный маятник — механическая система, состоящая из пружины с коэффициентом упругости (жёсткостью) k (закон Гука), один конец которой жёстко закреплён, а на втором находится груз массы m.
Когда на массивное тело действует упругая сила, возвращающая его в положение равновесия, оно совершает колебания около этого положения.Такое тело называют пружинным маятником. Колебания возникают под действием внешней силы. Колебания, которые продолжаются после того, как внешняя сила перестала действовать, называют свободными. Колебания, обусловленные действием внешней силы, называют вынужденными. При этом сама сила называется вынуждающей.
 |
Гармонічні коливання
 | |||
 |
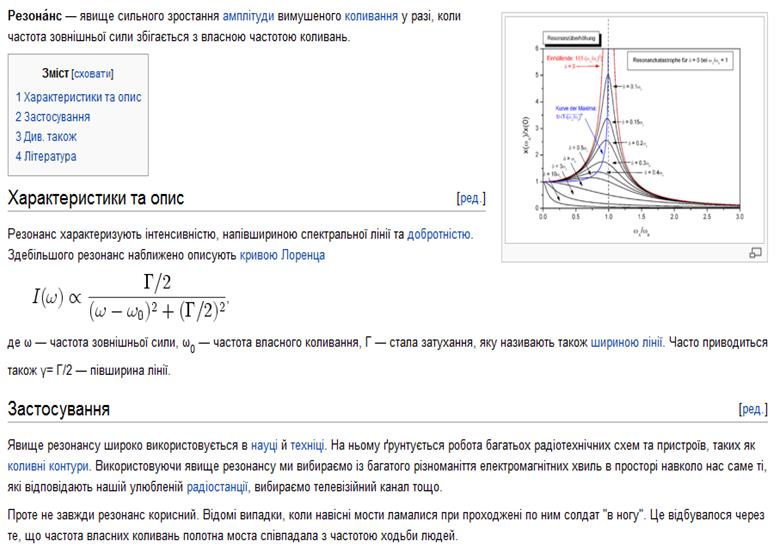
Коливання, які відбуваються в системі під дією зовнішньої періодичної сили, називаються вимушеними.
Сила, що викликає такі коливання, називається змушуючою силою.
Частота вимушених коливань дорівнює частоті змушуючої сили. Амплітуда вимушених коливань за незмінної частоти змушуючої сили залишається сталою.
Нехай до двох штативів прив'язано й натягнено шнурок, до якого підвішено математичні маятники (мал. 2). Два маятники мають однакову довжину. Привівши в коливання один із них, ми побачимо, що почнуть коливатися всі маятники. Однак той, який має таку ж довжину, що й маятник, приведений нами в рух, коливатиметься з найбільшою амплітудою. Позаяк довжина цих двох маятників однакова, то й однакові частоти їхніх вільних (власних) коливань, тоді як решта матимуть інші частоти власних коливань.


11.
 | ||
 |
Пружна хвиля називається синусоїдальною (або гармонічною), якщо відповідні їй коливання частинок середовища є гармонічними. На рис. 21 показана синусоїдальна поперечна хвиля, яка поширюється зі швидкістю υ уздовж осі х, тобто показана залежність між зміщенням U(x, t) частинок середовища, у хвильовому процесі, і відстанню х цих частинок від джерела коливань для будь-якого фіксованого моменту часу t.
Поздовжні хвилі можуть поширюватися в середовищах, у яких виникають пружні сили при деформаціях стиску і розтягу. Це означає, що поздовжні хвилі поширюються у твердих, рідких і газоподібних середовищ.
Поперечні хвилі можуть поширюватися в середовищах, у яких виникають пружні сили при деформаціях зсуву, тобто фактично тільки у твердих тілах. У рідинах і газах виникають лише подовжні хвилі, а у твердих тілах — як подовжні, так і поперечні хвилі.
Механічні або пружні хвилі - це процес розповсюдження механічних коливань в пружних середовищах. Механічні коливання частотного діапазону від 14 Гц до 20 кГц призводять до суб’єктивного відчуття звуку в органах слуху, тому вони носять назву звукових коливань або просто звуку. Відповідні до цього діапазону хвилі в пружних середовищах називаються звуковими хвилями. Розділ фізики, що вивчає закономірності звуку та звукових хвиль, називається акустикою (від грецького слова Ьκ ο υ σ τ ι κ ьζ - акустикос - слуховий). До акустичного діапазону відносять також інфразвук - коливання з частотами, нижчими від звукових, і ультразвук - коливання, частоти яких вищі ніж 20 кГц.
Коливання, що збуджуються в деякій частині пружного середовища, завдяки наявності пружних зв’язків між частинками середовища, розповсюджуються від джерела коливань на периферію, що сприймається як хвильовий процес. Хвилі являють собою процес передачі енергії без переносу речовини. В хвильовому процесі існує два характерних напрямки: напрямок коливань та напрямок їх розповсюдження. Якщо ці напрямки співпадають, то
хвилі називаються повздовжніми. У випадку, коли напрямок коливань та напрямок їх розповсюдження взаємно перпендикулярні хвилі називаються поперечними. Повздовжні хвилі можуть існувати в довільному пружному
середовищі. Поперечні хвилі розповсюджуються тільки в середовищах, що противляться деформаціям зсуву, тобто в твердих середовищах. В рідинах виникають особливі хвилі обумовлені нестискуваністю рідин, на їх поверхнях існують так звані поверхневі хвилі. При вивченні закономірностей хвильових процесів особливу роль мають гармонійні хвилі. По-перше тому, що згідно з гармонійним аналізом довільний складний хвильовий процес може бути представленим як
суперпозиція гармонійних хвиль. По-друге тому, що це найпростіші хвилі, їх вивчення дозволяє уяснити найбільш загальні властивості хвильових процесів.
 |
12.
Ідеа́ льний газ (рос. идеальный газ; англ. ideal gas, нім. ideales Gas n) — це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями до ідеального газу є реальні розріджені гази, тиск в яких не перевищує 200 атмосфер і які перебувають при не дуже низькій температурі, оскільки за таких умов відстань між молекулами набагато перевищує їх розміри.
Розрізняють три типи ідеального газу:
Класичний ідеальний газ або газ Максвелла-Больцмана.
Ідеальний квантовий газ Бозе (складається з бозонів). Див. статистика Бозе-Ейнштейна.
Ідеальний квантовий газ Фермі (складається з ферміонів). Див. статистика Фермі-Дірака.

Предмет дослідження. Термодинамічні системи.
Термодинамічні параметри. Термодинамічний та статистичний
методи дослідження термодинамічних систем.
Будову та внутрішній рух тіл та систем, що складаються з дуже великої кількості складових елементів (атомів, молекул, елементарних часток, інших тіл, навіть зірок та інших небесних тіл - молекул в подальшому) вивчають
два взаємодоповнюючих розділи фізики: молекулярна фізика та термодинаміка. Предмет їх дослідження носить назву термодинамічної системи. Дослідження термодинамічних систем відбувається принципово різними методами, які взаємно доповнюють один одного.
Термодинамічними називаються системи, що містять значну кількість складових елементів (теоретично N ≅ 1010...1020 елементів) і підкоряються законам термодинаміки. На практиці буває досить кількох сотень складових
елементів. Величини, що характеризують стан термодинамічної системи, носять назву параметрів стану. Основним параметром стану термодинамічної системи є її температура (Т). Температура характеризує ступінь нагрітості
системи і визначається через поняття теплової рівноваги системи чи систем. Тілам, що знаходяться в стані теплової рівноваги приписується однакова температура. Вимірюється температура термометрами.
Зміна температури системи призводить до зміну об’єму тіл, або тиску, або внутрішньої електропровідності і таке інше. Ці зміни легко відмічаються і використовуються для вимірів температури. Властивості, зміна яких використовується для вимірів температури, називаються термометричними, а тіла, що мають такі властивості, називаються термометричними тілами. Термометричні тіла становлять основу будови термометрів - приладів для
вимірювання температури. В міжнародній системі одиниць SІ температура вимірюється в кельвінах (К). Один кельвін - це одна сота температурного інтервалу від потрійної точки рівноваги води (рідина, лід і пара) до точки її кипіння. В
наукових дослідженнях використовується абсолютна термодинамічна шкала температур, яка будується за розглядом особливостей коефіцієнта корисноїдії (ККД) теплових машин. Тому, що він не може бути рівним нулю, або бути
більшим за нуль, термодинамічна температура може бути тільки позитивною (або тільки від’ємною, за домовленістю), абсолютний нуль температури - теоретично недосяжна величина. В протилежному випадку ККД теплових машин міг бути 100% або більше, що суперечить другому закону термодинаміки (і людському досвіду).
В практиці використовуються різні шкали. Найбільше використання має шкала Цельсія, де за нуль приймається точка танення льоду (потрійна точка), а за 100 оС - точка кипіння води. Одиниця вимірювання - 1 оС = 1 К.
Значення температури за різними шкалами зв’язані між собою: t = = Т- 273 К, де t - температура за шкалою Цельсія; Т - температура за абсолютною термодинамічною шкалою.
Молекулярно-кінетична теорія надає температурі фізичного змісту, як величині пропорційній середній кінетичній енергії поступального руху молекул. Внутрішньою енергією (Е) називається енергія тіл, що складають
систему. В найпростішому випадку вважається, що в системі не відбувається ні хімічних, ні термоядерних, ні інших перетворень такого роду. Тому внутрішня енергія системи - це енергія механічного руху (кінетична і потенціальна) структурних елементів (молекул), що створюють систему, енергія їх неупорядкованого руху.
Кількість теплоти (Q) є міра зміни внутрішньої енергії в теплових процесах, що не супроводжуються виконання механічної роботи (тобто в процесах, де внутрішня енергія хаотичного руху одних тіл переходить у внутрішню енергію інших тіл системи чи систем). Кількість теплоти, як і внутрішня енергія, вимірюється в джоулях.
Якщо параметри термодинамічної системи фіксовані, то йдеться про стан системи. Стан називається рівноважним, якщо кожен з параметрів у всіх точках системи має однакове значення. Зміна стану термодинамічної системи називається термодинамічним процесом. Термодинамічний процес, що відбувається через проміжні рівноважні стани, називається квазістатичним.
Рівняння стану ідеального газу - це рівняння, що поєднує параметри стану цього газу - p, V, T. Його виводять з основного рівняння МКТ у вигляді

 Добуток сталої Авогадро NA на сталу Больцмана k є сталою величиною, яку позначають як R = NAk. Числове значення універсальної газової сталої; R - це фундаментальна фізична стала, яка чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час його нагрівання на 1 К.
Добуток сталої Авогадро NA на сталу Больцмана k є сталою величиною, яку позначають як R = NAk. Числове значення універсальної газової сталої; R - це фундаментальна фізична стала, яка чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час його нагрівання на 1 К.
Остаточно знаходимо рівняння, яке містить тільки макроскопічні характеристики газу і є наслідком основного рівняння МКТ газів. Це рівняння називають рівнянням стану ідеального газу або рівнянням Клапейрона-Менделеєва:

--------------------------------------------------- 13 ------------------------------------------------------
 |
Рідина – конденсований агрегатний стан речовини, проміжний між твердим та газоподібним. Фізичне тіло, якому притаманна:
а) плинність на відміну від твердого тіла;
б) достатньо мала зміна об’єму (при зміні тиску й температури), на відміну від газу.
У рідині молекули здебільшого зберігають свою цілісність, хоча чимало рідин є розчинниками, в яких молекули до певної міри дисоціюють. При дисоціації в рідинах утворюються позитивно й негативно заряджені йони. Такі рідини проводять електричний струм (див. Електроліти).
З мікроскопічної точки зору рідини відрізняються від твердих тіл відсутністю далекого порядку, а від газів — ближнім порядком. Це означає, що атоми й молекули рідин здебільшого перебувають щодо своїх сусідів у тих же положеннях, що й у твердому стані, однак цей порядок зберігається для наступного шару сусідів гірше, а надалі зовсім зникає. Ближній порядок у рідинах характеризують радіальною кореляційною функцією.
Термодинамі́ чна фа́ за — термодинамічно рівноважний стан речовини, відмінний за своїми фізичними властивостями від інших станів тієї ж речовини. Різні фази мають різні упаковки молекул (для кристалічних фаз, різні кристалічні ґратки), і, отже, різні значення коефіцієнта стисливості, коефіцієнта теплового розширення та інші сприйнятливості. Крім того, різні фази можуть мати різні електричні (сегнетоелектрики), магнітні (феромагнетики), та оптичні властивості (наприклад, твердий кисень).
Термодинамічні фази і агрегатні стани речовини
Набір термодинамічних фаз речовини звичайно значно багатший за набір агрегатних станів, тобто один і той же агрегатний стан речовини може знаходитися в різних термодинамічних фазах. Саме тому опис речовини в термінах агрегатних станів досить огрублене, і воно не може розрізнити деякі фізичні різні ситуації.
Багатий набір термодинамічних фаз пов'язаний, як правило, з різними варіантами порядку, які допускаються в тому або іншому агрегатному стані.
У газоподібному стані речовина зовсім не впорядкована. Як наслідок, в газоподібному стані будь-яка речовина має лише одну термодинамічну фазу. (Фазові переходи типу дисоціації молекул або іонізації є, за визначенням, переходами однієї речовини в іншу).
Рідина має ближній порядок, але, як правило, не має дальнього порядку. В результаті у однієї і тієї ж рідини можуть бути різні термодинамічні фази, проте їхня кількість рідко перевищує одиницю. Так, наприклад, існування нової рідкої фази знайдено в переоходженій воді. Інший специфічний приклад: надплинний стан в рідкому гелії.
Кристалічне тверде тіло має як трансляційний порядок, так і орієнтаційний. В результаті виникає велике число можливих варіантів відносної орієнтації сусідніх молекул, які можуть виявитися енергетично вигідними при тих чи інших тиску й температурі. В результаті тверді тіла характеризуються, як правило, достатньо складною фазовою діаграмою. Наприклад, фазова діаграма такої, здавалося б, простої речовини, як лід, налічує принаймні 12 термодинамічних фаз, що реалізовуються при різних температурах і тисках.
При фазових переходах першого роду поглинається або виділяється прихована теплота. Фазові переходи другого роду відбуваються без поглинання чи виділення тепла. Така сучасна класифікація дещо відрізняється від класифікації Еренфеста, який назвав фазовими переходами першого роду переходи, при яких стрибком міняються перші похідні від вільної енергії, а фазовими переходами другого роду ті, при яких стрибком міняються, відповідно другі похідні від вільної енергії. Інші, відмінні від вільної енергії термодинамічні потенціали, наприклад, внутрішня енергія або ентальпія при фазових переходах першого роду міняються стрибком. Недоліком класифікації Еренфеста є те, що при деяких фазових переходах похідні від вільної енергії прямують до нескінченності, наприклад теплоємність при фазовому переході до феромагнітного стану.
Фазові переходи у твердих тілах
При підвищенні температури тверді тіла переходять у рідкий або газоподібний стан. Перехід твердого тіла в рідину називається плавленням, а перехід у газоподібний стан, минаючи рідкий, — сублімацією. Перехід до твердого тіла (при зниженні температури) — кристалізація, до аморфної фази — склування.
Існують також фазові переходи між твердотільними фазами, при яких змінюється внутрішня структура твердих тіл, стаючи упорядкованішою при пониженні температури.
1. Характерними особливостями твердих тіл є: здатність зберігати свої об’єм і форму.
Зовні тверді тіла можуть перебувати у суттєво різних станах, що відрізняються своєю внутрішньою будовою, - це кристалічний і аморфний стани.
Для кристалічних тіл характерними є:
Правильне розташування атомів молекул, іонів, які коливаються біля положення рівноваги, тобто створення кристалічної решітки;
Постійність кутів між гранями любого кристалу даної речовини і існування далекого порядку в розміщенні частинок.
У аморфних речовин немає кристалічної структури (скло). Внутрішня будова аморфних тіл наближається до внутрішньої будови рідин, тому їх називають переохолодженими рідинами.
Деякі речовини можуть перебувати у кристалічному і аморфному стані.
2. Залежність фізичних властивостей (механічних, оптичних, електричних, теплових) від напряму в середині монокристалів, називають анізотропією.
(Монокристал - це один кристал).
Полікристали є ізотропними. Ідеально далекого порядку в розташуванні твердої речовини немає.
Відхилення від ідеального порядку називають дефектами просторової (кристалічної) решітки.
Види кристалічних структур.
Є чотири види:
Іонна – у вузлах решітки знаходяться позитивні і негативні іони, які втримуються електричними силами притягання і відштовхування.
Наприклад Na+Cl-


Атомна - у вузлах знаходяться нейтральні атоми, між якими встановлюється ковалентний зв’язок.
Молекулярна - у вузлах знаходяться нейтральні молекули, які втримуються молекулярними силами (дуже слабий зв’язок), нафталін.
Металічна - у вузлах занаходяться позитивно заряджені іони металу, між якими хаотично рухаються вільні електрони.

3. Плавлення – це перехід речовин з твердого стану в рідкий.
Твердення – це перехід речовини з рідкого стану в твердий стан.
У кристалічних тіл є температура плавлення. У аморфних тіл немає температури плавлення, вони поступово нагріваються, розм’якшуються і плавляться.
Структура рідин: близький порядок, радіальна функція розподілу
Завдяки взаємодії молекули в рідині розташовані не зовсім хаотично. Для характеристики взаємного положення молекул використовується поняття радіальної функції розподілу, яка пропорційна ймовірністі того, що на певній віддалі від якоїсь довільно-вибраної молекули, перебуватиме інша молекула. Для ідеального газу радіальна функція розподілу не залежить від віддалі і всюди дорівноє одиниці - рух молекул газу нескорельований, ймовірність знайти іншу молекулу на певній віддалі однакова. Для кристалу така функція розподілу складається із виразних максимумів, висота яких практично не зменшується з віддаллю. Говорять, що в кристалах зберігається далекий порядок. В рідинах радіальна функція розподілу має кілька максимумів, висота яких зменшується з віддаллю і через кілька середніх міжмолекулярних віддалей стає рівною одиниці. Говорять, що в рідинах зберігається ближній порядок, і не зберігається дальній порядок.
Експериментально радіальну функцію розподілу можна одержати, проаналізувавши дані експериментів із розсіяння рентгенівських променів чи нейтронів.
Мала стисливість рідин пояснюється великим зростанням сил відштовхування між частинками рідини при незначному наближенні одної частинки до другої..
--------------------------------------------------- 13 ------------------------------------------------------------
|
|