
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Возраста в патологии
|
|
Глава 4
РОЛЬ НАСЛЕДСТВЕННОСТИ, КОНСТИТУЦИИ И
ВОЗРАСТА В ПАТОЛОГИИ
4.1. НАСЛЕДСТВЕННОСТЬ И ПАТОЛОГИЯ. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ
4.1.1. Изменчивость наследственных признаков как основа патологии
Наследственность как способность организмов передавать разнообразные (морфологические, функциональные, биохимические) признаки своим потомкам определяется стабильностью функционирования или консерватизмом генетического аппарата. Но это лишь одна сторона явления наследственности. Другой ее стороной является изменчивость (наследственная изменчивость). Лишь в своей совокупности наследственность и изменчивость обеспечили и сохранение жизни на Земле, и непрерывную биологическую эволюцию. Наследственная изменчивость организма обеспечивает необходимую ему приспособляемость к условиям существования как в пределах жизни одного индивида, так и в рамках существования биологического вида в целом.
Наследственное разнообразие человека - это результат длительной эволюции живой материи. При этом надо иметь в виду особенности эволюции человека как биологического и социального существа. У человека как социального существа естественный отбор протекал со временем все в более и более специфических формах, что, безусловно, расширяло наследственное разнообразие популяций. Сохранялось то, что могло отметаться у животных или, напротив, терялось то, что нужно животным. Например, более полноценное обеспечение себя пищей и возможность восполнять потребность в витамине С «позволили» человеку в процессе эволюции «утерять» ген фермента L-гулонолактоноксидазы, катализирующей у животных синтез аскорбиновой кислоты. Наличие этого гена у животных гарантирует их от развития цинги, а человек
из-за такой «всеобщей врожденной ошибки метаболизма» подвержен авитаминозу С. В процессе эволюции человек и «приобретал» нежелательные признаки, имеющие прямое отношение к патологии. Большинство видов животных невосприимчиво к дифтерийному токсину и вирусу полиомиелита, потому что у них отсутствуют компоненты мембраны клеток, обеспечивающие восприятие того или другого патогенного фактора. У человека эти компоненты есть. Гены, их детерминирующие, уже идентифицированы. Для восприятия дифтерийного токсина, например, он локализован в 5-й хромосоме, для вируса полиомиелита - в 19-й.
Ни у одного биологического вида, в том числе и у человека, нет резкой границы между наследственной изменчивостью, ведущей к нормальным вариациям признаков, и наследственной изменчивостью, определяющей патологические вариации (наследственные болезни). Большинство мутаций увеличивает полиморфизм человеческих популяций (группы крови, цвет волос, рост, разрез глаз и т.д.), но в ряде случаев мутации затрагивают жизненно важные функции, а это уже приводит к болезни. Таким образом, наследственная патология - это часть наследственной изменчивости, накопившейся за время эволюции человека. Человек, став биологическим видом homo sapiens (человек разумный), как бы заплатил за «сапиентацию» своего вида накоплением патологических мутаций. На основе этих положений формулируется одна из главных концепций медицинской генетики об эволюционном накоплении патологических мутаций в человеческих популяциях. Подтверждением этой концепции являются патологические мутации у животных, по своим проявлениям сходные с наследственными болезнями у человека (ахондроплазии, гемофилии, мышечные дистрофии и многие другие у коров, свиней, овец, кошек, собак, грызунов), а также наличие наследственных болезней у людей, живших несколько тысячелетий назад, о чем можно судить по раскопкам и произведениям искусства.
Часть I. ОБЩАЯ НОЗОЛОГИЯ
Основным источником многообразия наследственных признаков и их непрекращающейся эволюции служит мутационная изменчивость. Способность ДНК мутировать сложилась в эволюции и закрепилась отбором, по-видимому, так же, как и способность противостоять мутационным изменениям, т.е. репарировать их. Следовательно, в организации ДНК заложены как вероятность ошибок ее репликации, так и возможность изменения ее первичной структуры. Вероятность «сбоя» в точности репликации молекулы ДНК невелика. Она составляет одно событие на 10" 5-10'7 нуклеотидов. Однако, принимая во внимание исключительно большое число нуклеотидов в геноме (3, 3 млрд нуклеотидов на гаплоидный набор), следует признать, что в сумме на геном клетки на одно ее поколение приходится несколько мутаций в структурных генах. Считается, что каждый индивид наследует 2-3 новых вредных мутации, которые могут вызывать летальный эффект.
Изменение нуклеотидной последовательности молекулы ДНК может отразиться на первичной (аминокислотной) структуре белка или на регуляции его синтеза. Так, большой опыт изучения молекулярной природы мутаций гемоглобина показывает, что значительная часть таких мутаций не изменяет функции гемоглобина. Такие мутации нейтральны и не подвергаются отбору. Другие мутации приводят к функциональным отклонениям в молекуле белка. Эти отклонения в каких-то условиях жизни организма могут оказаться полезными, т.е. иметь адаптивное значение, поэтому сохраняются и размножаются в последующих поколениях. Именно таким путем возникали и сохранялись в популяциях разнообразные варианты структурных, транспортных и ферментных белков организма. Свойственный организму широкий белковый полиморфизм, благодаря которому каждый индивид биохимически неповторим, обусловлен мутационной изменчивостью и отбором адаптивных белковых вариантов. Если структурные отклонения несовместимы с выполнением белком его функции, а функции жизненно важны для клетки, для организма, мутация становится патологической и в дальнейшем либо исключается из популяции вместе с нежизнеспособной клеткой (организмом), либо сохраняется, обусловливая наследственную болезнь. В отдельных случаях гетерозиготные носители патологической мута-
ции подвергаются положительному отбору. Примером этого служит ген серповидноклеточной анемии, который широко распространился в популяциях, проживающих в эндемичных по малярии районах, вследствие устойчивости гетерозиготных носителей «аномального» гена (му-тантного аллеля) к малярийному плазмодию.
Различные признаки организма по-разному устойчивы к мутационным изменениям, что связано, по-видимому, со значением признака и его эволюционным «возрастом». Такие признаки, как гистоновые белки, входящие в состав хромосом, или сократительные белки актин и тубу-лин, или ферментные белки репликации и транскрипции, весьма консервативны и одинаковы не только у разных представителей человечества, но и у биологических видов значительной филогенетической отдаленности. По-видимому, мутации в соответствующих генах летальны. Большинство же белков организма, особенно ферментных, существуют в нескольких изоформах и подвержены таким мутационным изменениям, которые ведут к патологии.
Патологические мутации различны по способности сохраняться и распространяться в популяциях. Одни из них, позволяющие их носителю сохранять плодовитость и не вызывающие серьезных неблагоприятных сдвигов в фенотипе, могут передаваться из поколения в поколение длительное время. Такие признаки сегрегируют (распределяются) в поколениях согласно законам Менделя, и обусловленный ими генетический груз в популяциях может долго сохраняться. Некоторые комбинации условно патологических рецессивных аллелей могут давать селективное преимущество индивидам (выживаемость, плодовитость). Частота таких аллелей в популяции будет повышаться до определенного уровня в ряду поколений, пока не наступит равновесие между мутационным процессом и отбором. Частота разных мутантных аллелей этого рода может быть неодинаковой в различных популяциях, что определяется популяционными закономерностями (эффект родоначальника, частота кровнородственных браков, миграция и экологические условия). Если вновь возникшая мутация имеет доминантное патологическое проявление и ведет к летальному генетическому исходу (индивид не оставляет потомства), то такой мутационный груз не передается следующему поколению. Это обычно доминантные формы
Глава 4 / РОЛЬ НАСЛЕДСТВЕННОСТИ, КОНСТИТУЦИИ И ВОЗРАСТА В ПАТОЛОГИИ
тяжелых болезней, а также большая часть хромосомных болезней.
В целом эффекты генетического «груза» у человека выражены в эволюционно-генетических явлениях балансированного полиморфизма, летальности и сниженной фертильности.
На основе постоянно протекающих процессов изменения наследственности (мутаций) и отбора генотипов в процессе длительной эволюции человека в популяциях сформировался балансированный полиморфизм. Под этим названием понимают такое явление, когда в популяции представлены две или более формы аллелей одного гена, причем частота редкого аллеля составляет не менее 1 %. Поскольку возникновение мутаций - это редкое событие (1 • 10 7), то, следовательно, частоту мутантного аллеля в популяции более 1% можно объяснить селективным преимуществом этого аллеля для организма и постепенным накоплением в ряду поколений после его появления. Примерами балансированного полиморфизма являются группы крови ABO, Rh, гены муковисцидоза, фенил-кетонурии, первичного гемохроматоза. Генетическое многообразие человека основано на балансированном полиморфизме, формировавшемся в течение десятков и сотен тысячелетий. Такое многообразие является основой развития человека как биологического вида. Вероятность возникновения и фиксации в популяциях какой-либо мутации с положительным эффектом в эволюционно «отлаженном» человеческом организме существует и в настоящее время, но она крайне мала. Практически новые мутации всегда обладают отрицательным эффектом.
К эффектам мутационного груза относится летальность. Она проявляется на уровне гибели гамет, зигот, эмбрионов, плодов, детей. Наиболее интенсивно летальные эффекты выражены в человеческих популяциях на уровне зигот. Примерно 60% зигот погибает до имплантации, т.е. до клинически регистрируемой беременности. Исходы всех клинически зарегистрированных беременностей распределяются следующим образом: спонтанные аборты - 15%, мер-творождения - 1% и живорождения - (84%). Из 1000 новорожденных детей не менее 5 умирают в возрасте до года по причине наследственной патологии, не совместимой с жизнью. Таков объем летального груза мутационной изменчи-
вости в популяциях человека с медицинской точки зрения.
Для большинства наследственных болезней характерна сниженная фертильность, обусловленная нарушением репродуктивной функции. Это ведет к уменьшенному воспроизводству потомства (и больного, и здорового) в семьях с наследственной патологией.
Медицинские и социальные последствия мутационного процесса - это социальная дезадаптация больных, повышенная потребность в медицинской помощи и сниженная продолжительность жизни.
Социальная дезадаптация больных связана с их инвалидностью, чаще всего - с детского возраста. В течение многих лет наследственные больные относятся к категории инвалидов, которые не могут себя обслуживать. В среднем такие дети в интернатах живут до 10 лет. Из 1 млн новорожденных примерно 5000 рождаются «кандидатами» на многолетнюю тяжелую инвалидность с детства. Медицинскую помощь лицам с наследственными болезнями в поликлинических условиях оказывают в 5-6 раз чаще. Среди контингента детских больниц общего профиля от 10 до 20 % - это дети с наследственной патологией, что в 5-10 раз выше, чем частота таких больных в популяции. Продолжительность жизни у больных с наследственной патологией зависит от формы болезни и уровня медицинской помощи. Хотя точные расчеты еще не сделаны, но для стран с хорошо развитой системой здравоохранения можно с большой уверенностью полагать, что не менее 50% всех пациентов с наследственными болезнями умирают в детском возрасте. В Канаде проведена комплексная оценка ожидаемой продолжительности жизни для всех больных с наследственной патологией (с разным возрастом начала болезней и тяжести течения). Она оказалась на 20 лет меньше средней по стране (50 лет вместо 70).
4.1.2. Роль наследственности и среды в развитии патологии
Любые проявления жизнедеятельности организма являются результатом взаимодействия наследственных и средовых факторов. Болезнь также развивается на основе тесного взаимодействия внешних повреждающих и внутренних факторов. Если сами внутренние факторы наслед-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
ственно изменены, то возникает патологический процесс. Факторы внутренней среды - это в конечном счете результат взаимодействия генетических и средовых факторов в онтогенезе, потому что уровень гормонов в организме, особенности обмена веществ, иммунологические реакции - все это исходно определяется функционированием соответствующих генов.
Наследственные факторы, определяющие основу внутренней среды организма в широком смысле слова, принимают самое непосредственное участие в формировании патологических процессов, выступая в роли либо этиологического, либо патогенетического фактора заболевания. Процессы выздоровления и исхода болезни при прочих равных условиях во многом определяются генетической конституцией организма. Более того, генетические факторы существенно определяют даже смертность в возрасте от 20 до 60 лет. Об этом можно судить на основании обстоятельного близнецового исследования. Кон-кордантность близнецов по смертности в возрасте 20 - 60 лет от всех болезней составила у монозиготных пар 30, 1%, а у дизиготных - 17, 4%. Даже по смертности от травм конкордантность у монозиготных близнецов выше (6, 9%), чем у дизиготных (3, 9%).
Все существующие болезни человека (более 30 тыс.) в зависимости от роли наследственных (G) и средовых (Е) факторов в их развитии могут быть расположены на линии в данных (G-genome, геном; E-environment, среда) координатах (рис. 18).
Первая группа - это наследственные болезни, при которых проявление патологического действия мутации как этиологического фактора практически не зависит от среды. Последняя может только менять выраженность симптомов болезни и тяжесть ее течения. К заболеваниям этой группы относятся хромосомные и генные наследственные болезни с полным проявлением (болезнь Дауна, нейрофиброматоз, гемофилия, фенилкетонурия, муковисцидоз, ахондроплазия и т.д.), а также врожденные аномалии развития полигенной природы. Болезнь может проявляться не обязательно в детском, но и в любом возрасте, в соответствии с временными закономерностями генной экспрессии (например, средний возраст начала хореи Гентингтона равен 38-40 годам).
Во второй группе болезней наследственность
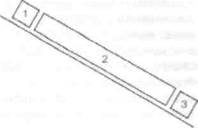
 Рис. 18. Соотносительная роль генетических (G) и средовых (Е) факторов в развитии болезней человека:
Рис. 18. Соотносительная роль генетических (G) и средовых (Е) факторов в развитии болезней человека:
1 - «строго» наследственные болезни;
2 - болезни с наследственной предрасположенностью;
3 - «ненаследственные» болезни
может являться этиологическим или патогенетическим фактором, но для пенетрантности му-тантных генов необходимы соответствующие факторы окружающей среды. К таким заболеваниям относятся, например, некоторые формы подагры, диабета, а также фармако- и экогене-тические реакции. Подобные заболевания и патологические реакции обычно проявляются неожиданно в разном возрасте при первом контакте с проявляющим внешним фактором, специфическим для каждого мутантного гена. Чаще для этой группы болезней этиологическими факторами являются многочисленные средовые влияния, однако частота возникновения и тяжесть течения болезней существенно зависят от наследственного предрасположения (как в индивидуальном варианте, так и в групповом). К заболеваниям этой группы относятся атеросклероз, гипертоническая болезнь, туберкулез, экзема, псориаз, язвенная болезнь и др., т.е. это болезни с наследственным предрасположением, или мультифакториальные заболевания.
В происхождении болезней третьей группы наследственность не играет этиологической роли (ненаследственные болезни). Сюда относится большинство травм, инфекционных заболеваний, ожогов и т.д. Однако генетические факторы могут влиять на течение патологических и восстановительных процессов.
4.1.3. Мутации как этиологический фактор наследственной патологии
Этиологическими факторами наследственных болезней являются геномные, хромосомные и
Глава 4 / РОЛЬ НАСЛЕДСТВЕННОСТИ, КОНСТИТУЦИИ И ВОЗРАСТА В ПАТОЛОГИИ
генные мутации. Заболевания, связанные с геномными (изменение числа хромосом) и хромосомными (изменения структуры хромосом) мутациями, носят название хромосомных болезней. Как правило, при хромосомных болезнях нарушаются сбалансированный набор генов и строгая детерминированность нормального развития организма, что приводит к внутриутробной гибели эмбрионов и плодов, к врожденным порокам развития и других элементов клинической картины хромосомных болезней.
Большинство форм наследственных заболеваний обусловлено генными мутациями, т.е. молекулярными изменениями на уровне ДНК (му-ковисцидоз, гемофилия, фенилкетонурия, нейрофиброматоз, миопатия Дюшенна и т.д.). Мутации транскрибируемых участков (определяющих аминокислотную последовательность синтезируемого белка) приводят к синтезу аномального продукта, в то время как мутации не-транскрибируемых областей могут приводить к снижению скорости синтеза белка. Феноти-пически генные мутации могут проявляться на молекулярном, клеточном, тканевом и органном уровнях.
Число генных болезней можно определить только ориентировочно (около 4, 5 тыс.), потому что нет строгих критериев для нозологических форм ни с клинической, ни с генетической точки зрения. Например, с клинической точки зрения миопатии Дюшенна - Беккера являются разными формами, а с генетической точки зрения -это результат мутации в одном и том же локусе.
Генные нарушения наследуются в строгом соответствии с законами Менделя на основе принципа конвариантной редупликации. Но унаследование патологического гена (а в случае рецессивных мутаций - двух аллелей) не всегда сопровождается развернутой клинической картиной. Выше уже говорилось о возможном влиянии факторов внешней среды на проявление генов. Однако и другие гены, формирующие генотип особи, т.е. генетическую конституцию индивида, могут модифицировать проявление патологического гена. В таких случаях говорят о неполной пенетрантности и варьирующей экспрессивности. Поскольку генетическая среда для патологического гена всегда индивидуальна, возникают широкие возможности для разного проявления этого гена у различных индивидов.
Многие генные мутации обусловливают возникновение таких молекулярных форм белков, патологическое действие которых выявляется не в обычных условиях, а только при взаимодействии со специфическими факторами внешней среды. Это так называемые экогенетические вари-ции. Например, у лиц с мутациями в локусе глюкозо-6-фосфатдегидрогеназы (Г6ФДГ) при лечении сульфаниламидными препаратами наблюдается гемолиз эритроцитов, у лиц с аномальной холинэстеразой введение дитилина приводит к длительной остановке дыхания.
4.1.4. Феноменология проявления генов
Знание феноменологии проявления генов позволяет сформулировать представления о способах взаимосвязи между генами и признаками, которые составляют содержание «генетической физиологии развития». Об этом впервые было заявлено в 30-е годы отечественным генетиком Н.В. Тимофеевым-Ресовским, который к общим феноменам проявления генов относил: доминантность и рецессивность, гетерогенные гены (гено-копии), полифенные (плейотропные) гены и феномены вариабельности проявления генов (пе-нетрантность, экспрессивность, поле действия гена). Позднее, спустя сорокалетие, известный американский генетик В.А. Маккьюсик сформулировал так называемые «принципы клинической генетики», к которым, наряду с явлениями доминантности и рецессивности, отнес три главных - плейотропизм, клинический полиморфизм, генетическую гетерогенность.
В отношении феноменов доминантности и рецессивности следует иметь в виду три основных момента. Во-первых, они определяют свойства фенотипов, а не гена или аллеля. Во-вторых, представляют собой условные (эмпирические) термины, не предполагающие фундаментальных различий в генетических механизмах. Наконец, доминантность и рецессивность определяются чувствительностью методов, используемых для исследования фенотипа, а по мере приближения к первичному эффекту гена вообще теряют свою значимость. Примером последнего могут служить генетические компаунды, известные для некоторых наследственных болезней (гемоглобинемии, муковисцидоз, мукополисаха-ридоз Гурлера - Шейе). Суть этого явления зак-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
лючается в следующем: при использовании тонких методов биохимического анализа в таких случаях обнаруживается, что аллели одного гена нередко различаются, т.е. больные рецессивными заболеваниями являются не гомозиготами, а гетерозиготами, «состоящими» из двух мутаций одного и того же гена (составные гетерозиготы, или компаунды).
Под плейотропностью («плейотропизм») понимают влияние одного гена на развитие двух и более стенотипических признаков, т.е. одна мутация, приводящая к изменению активности фермента или структуры белка, важных для функционирования многих тканей разных органов индивида, определяет множественные эффекты. Иллюстрацией плейотропного действия мутаций может служить мутация гена фосфофрук-токиназы (PFK). Данная мутация определяет недостаточность фермента PFK, что приводит к умеренной несфероцитарнои гемолитической анемии средней тяжести, желтухе, увеличению селезенки. Эти фенотипические изменения объясняются сокращением времени жизни эритроцитов. Проявление этого дефекта ограничено только эритроцитами, так как у таких больных сохраняется нормальной активность фермента PFK в лейкоцитах, тромбоцитах и скелетных мышцах. Другой пример - мутация в гене фибрилли-на, локализованном в 15q21.1 (синдром Марфа-на), определяет чрезвычайно яркий многосимп-гомный фенотип: высокий рост, арахнодактилия, гиперподвижность суставов, подвывих хрусталика, аневризма аорты (рис. 19, вклейка).
Клинический полиморфизм наследственных болезней проявляется в различии у индивидов времени начала болезни, в динамике появления симптомов, в их спектре, сочетании и степени выраженности, в течении болезни и ее исходе. Клиническая картина конкретной моногенной наследственной болезни может варьировать не только у индивидов из разных семей, но и у членов одной семьи, в которой разные больные имеют идентичный по происхождению патологический ген. Генетической причиной полиморфизма может быть явление взаимодействия главного гена и генов модификаторов (эпистаз, особенности инактивации и дозовая компенсация Х-хро-мосомы, цитоплазматический геном), с другой стороны - это могут быть и факторы внешней среды, в которых осуществляется развитие индивида. Рис.20 иллюстрирует влияние назван-
ных двух групп факторов (генетических и внеш-несредовых) на фенотипы моногенных болезней. Так, фенилкетонурия в пространстве двух обозначенных координат занимает срединное положение, отражая заметное влияние средовых и случайных факторов, а также эффектов других генов на клинические проявления болезней. В то же время для болезни Тея - Сакса влияние этих факторов менее выражено, а в клинических проявлениях недостаточности Г6ФДГ преобладающим модифицирующим фактором является внешняя среда.
С.Н. Давиденков (1925) был одним из первых, обративших внимание на важность явления генетической гетерогенности наследственных болезней: «...один и тот же фенотип может быть реализован различными генными комбинациями». К настоящему времени доказано, что сходное или идентичное фенотипическое проявление болезни часто обусловлено несколькими разными мутациями. Генетическая гетерогенность может определяться мутациями разных генов (межлокусная гетерогенность) или множественным аллелизмом отдельного конкретного гена (внутрилокусная гетерогенность). Так, межлокусная гетерогенность известна для наследственных форм эпилепсии - около 20 генов, в
G
Рис. 20. Потенциальное влияние генотипических
(G) и негенетических (Е) факторов на фенотип
некоторых моногенных болезней
(гео Ч. Скрайверу и Уотерсу)
Глава 4 / РОЛЬ НАСЛЕДСТВЕННОСТИ, КОНСТИТУЦИИ И ВОЗРАСТА В ПАТОЛОГИИ
Гены эпилепсии человека (по Г.Эллену с соавт.)
Таблица 12
| Наименование болезни | Локализация в хромосоме | Ген |
| Идиопатические генерализованные эпилепсии | ||
| Ювенильная миоклональная эпилепсия | 6р | ? |
| Семейные неопасные конвульсии (BFNC1) | 20q | ? |
| Семейные неопасные конвульсии (BFNC1) | 8q | ? |
| Идеопатическая генерализованная эпилепсия (IGE) | 8q | ? |
| Идиопатические парциональные эпилепсии | ||
| Парциальная эпилепсия со слуховыми симптомами (ЕРТ) | 10q | ? |
| Ночная эпилепсия фронтальной доли | 20q | |
| Моногенные нарушения с симптоматикой эпилепсии в качестве основного признака | ||
| Болезнь Унферрихта-Лундборга (ЕРМТ) | 21q22.3 | Цистанин В |
| Миоклонус-эпилепсия, рваные красные мышечные волокна (MERRF) | Митохон. геном | TPHK(Lys) |
| Синдром северной эпилепсии (EPMR) | 8q | ? |
| Цероидный липофусциноз, ювенильный тип (CLN3) | 16q | CLN3 |
| Миоклональная эпилепсия Лафора (MELF) | 6q23 | ? |
| Околожелудочковая гетеротипия (РН) | Xq28 | ? |
том числе митохондриальные (табл.12), для врожденных хондродисплазий - более 10 разных генов.
Примером внутрилокусной генетической гетерогенности могут быть разные мутации в гене дистрофина: одни из них ведут к миопатии Дю-шенна, другие - к миопатии Беккера, являющимся, как известно, разными клиническими формами в ряду нервно-мышечных заболеваний.
4.1.5. Генетические основы гомеостаза
Гомеостаз как способность организма сохранять равновесие своей внутренней среды в условиях постоянно изменяющейся окружающей среды всегда основан на норме реакции, под которой понимают размах колебаний ответных реакций организма на внешние воздействия без патологических отклонений. Эти реакции обусловлены врожденными характеристиками организма, которые обеспечивают ему возможность вариаций любых признаков или параметров (функциональных, морфологических, биохимических, иммунологических) в доступных для организма пределах без неблагоприятных последствий. Не вызывает сомнений изначальная наследственная обусловленность как индивидуальных, так и видовых признаков организма.
Наследственная информация, реализующаяся в индивидуальном развитии организма через биосинтез РНК и белков, обеспечивает формирование признаков и свойств организма не как стабильных, а как способных к определенной вариабельности. Размах этой вариабельности, или его нижние и верхние границы, строго индивидуальны. Таким образом, норма реакции генетически обусловлена и формируется в процессе онтогенеза как один из элементов фенотипа в целом. В эволюционном формировании как самой нормы реакции, так и ее генотипической обусловленности естественный отбор закрепил гибкие и варьирующие реакции организма на внешние воздействия или, другими словами, закрепил норму реакции. Следовательно, с позиции генетики гомеостаз является генетически обусловленным компонентом фенотипа.
На рис. 21 представлено взаимодействие факторов среды и генетически детерминированных норм реакций в обеспечении здоровья или развития болезни. Здоровье поддерживается за счет гомеостаза всех компонентов внутренней среды организма на основе нормы реакции. Нарушение гомеостаза (дисгомеостаз) проявляется в виде болезни. Причинами дисгомеостаза могут быть: 1) усиленные воздействия факторов среды; 2) ограниченные возможности врожденной нормы реакции организма.
Часть I. ОБЩАЯ НОЗОЛОГИЯ
Основу надежности генотипа составляют
следующие характеристики строения и функционирования генома человека: 1) дублирован-ность его структурных элементов; 2) матричный принцип биосинтеза; 3) способность к репарации; 4) регуляция генной активности.
Дублированностью генетических элементов не исчерпываются компоненты стабильности генотипа. Гомеостаз самого генотипа заложен в матричном принципе биосинтеза ДНК (репликация) и РНК (транскрипция). Этот принцип обеспечивается двумя замечательными особенностями молекулы ДНК: двухспиральностью молекулярной структуры и способностью каждой из полинуклеотидных нитей-спиралей служить матрицей для синтеза новой нуклеотидной нити, которая комплементарна исходной нити и поэтому полностью соответствует ей. В процессе репликации самой ДНК обеспечивается точное воспроизведение генетической информации в ряду последовательных актов синтеза ДНК и последующих клеточных делений. В процессе транскрипции матричный синтез гарантирует точную, неискаженную трансформацию закодированной в ДНК генетической информации через нуклеотидные последовательности РНК в
Рис. 21. Здоровье как гомеостаз (по Ч. Скрайверу, модифицировано): А - здоровье поддерживается на основе генетически детерминированной нормы реакции, обеспечивающей гомеостаз при умеренном воздействии факторов среды; Б - болезнь, обусловленная усиленным действием факторов среды, которые выходят за пределы возможной нормы реакции (дисгомеостаз); В - болезнь, обусловленная генетически уменьшенной нормой реакции, при которой дисгомеостаз возникает при умеренных воздействиях факторов среды
первичную аминокислотную последовательность специфических белков.
Эволюция обеспечила клетки разносторонними механизмами восстановления (или репарации) повреждений генетических структур (ДНК и хромосом). Абсолютно стабильного в организме ничего не может быть, в том числе не может быть абсолютно устойчивым генетический аппарат клеток. Первичная структура ДНК, хотя и с малой частотой, может изменяться при репликации ДНК. Эти события известны как «ошибки репликации». В гораздо большей степени ДНК повреждается от воздействия мутагенов.
К настоящему времени открыто несколько механизмов, с помощью которых устраняются те или иные повреждения ДНК. В их основе лежат ферментативные процессы.
Гомеостаз внутренней среды организма должен обеспечиваться, помимо выше изложенных фундаментальных механизмов, надежностью генетического контроля генной активности. Механизмы такого контроля на молекулярном и надмолекулярном уровнях пока не раскрыты.
Хотя еще не полностью выявлено, какими механизмами генетическая детерминация гоме-остаза обеспечивает постоянство внутренней среды организма (фенотипический уровень), все же можно предположить, что речь при этом идет о молекулярно-генетических и биохимических цепочках событий от гена до признака. В ряде примеров можно расчленить физиологические механизмы гомеостатической реакции на составляющие ее компоненты.
В общей форме можно говорить о двух видах генетической детерминации гомеостаза. Один из них - контроль элементарных проявлений гомеостаза организма (выделение гормона, синтез фермента и т.д.). Другая группа проявлений гомеостаза - системные проявления. Разумеется, границы между элементарными и системными проявлениями гомеостаза условны. Чем больше расшифровывается цепочек генетической детерминации элементарных проявлений гомеостаза и чем глубже познаются звенья каждой из них, тем полнее и предметнее становятся наши представления о генетике и физиологии гомеостаза в целом. В качестве примеров генетической обусловленности элементарной гомеостатической реакции можно привести генетический контроль свертываемости крови.
Генетический анализ системных проявлений
Глава 4 / РОЛЬ НАСЛЕДСТВЕННОСТИ, КОНСТИТУЦИИ И ВОЗРАСТА В ПАТОЛОГИИ
гомеостаза представляет трудную задачу. Эти проявления интегральны, их невозможно свести к простой сумме элементарных реакций, за которыми стоят конкретные цепочки: ген -» первичный его продукт -> метаболические превращения продукта. На более высоком, системно-органном уровне вступают в действие физиологические механизмы регуляции функций. Однако и в этом случае глубинную основу таких регуляций составляют унаследованные нормы реакций.
4.1.6. Классификация наследственной патологии
Существуют наследственные, врожденные, семейные и спорадические заболевания.
Термин «наследственные болезни» не тождествен термину «врожденные болезни». Под врожденными болезнями понимают такие состояния, которые существуют уже при рождении ребенка. Врожденные болезни могут быть обусловлены наследственными и ненаследственными факторами. К последним относятся все врожденные пороки, возникающие за счет тератогенного действия внешних факторов, врожденные инфекции (сифилис, краснуха и др.). В то же время не все наследственные болезни являются врожденными. Некоторые заболевания проявляются в детском (миопатия Дюшенна, муковис-цидоз), другие в зрелом (миотоническая дистрофия, хорея Гентингтона) и даже в пожилом (болезнь Альцгеймера) возрасте.
Термин «семейные болезни» также не является синонимом термина «наследственные болезни». Семейные болезни могут быть наследственными и ненаследственными. Этот термин не говорит ни о чем, кроме того, что заболевание встречается среди членов одной семьи, да и само понятие семьи включает родственников от двух до нескольких поколений. Болезнь может быть обусловлена влиянием одинакового вредного фактора, который действует в семье: неправильное питание, плохая освещенность, сырая квартира, одна и та же вредная профессия в семье (шахтеры, ткачи и др.).
Иногда подразделяют заболевания на семейные и спорадические. При этом подразумевается: для «семейного» - наличие заболевания в семье, а для «спорадического» - его отсутствие. Таким образом, при подобном определении большинство рецессивных заболеваний будет отно-
ситься к группе спорадических, поскольку в родословных (особенно если родословная не очень большая) часто не наблюдается других случаев этого заболевания. Термин «спорадический» можно с известной долей условности применять в случаях доминантных и хромосомных болезней. Спорадические случаи противопоставляются «унаследованным» от больного родителя, т.е. термин «спорадичность» подчеркивает первичное возникновение мутации.
Как известно, в зависимости от уровня организации наследственных структур различают генные, хромосомные и геномные мутации, а в зависимости от типа клеток - гаметические и соматические.
Классификация наследственных болезней, в основу которой положены два варианта мутаций - в половых и соматических клетках, была предложена В.А. Маккьюсиком (1988) и включает три формы наследственной патологии:
1. Болезни вследствие мутаций в половых клетках (собственно наследственные болезни). С учетом уровня организации наследственных структур среди них различают хромосомные (например, синдром Дауна), генные (мутации в отдельном гене, которые обобщаются в периодически издающемся каталоге В.А. Маккьюсика «Менделевская наследственность у человека») и мультилокусные (полигенные, мультифактори-альные).
2. Болезни вследствие мутаций соматических клеток: опухоли, некоторые аутоиммунные болезни, некоторые пороки развития. Как и в первой группе болезней, среди них выделяют хромосомные, генные, мультифакториальные.
3. Болезни, представляющие комбинацию мутаций в половых и соматических клетках (например, семейная ретинобластома).
Наследственные болезни настолько разнообразны, что они встречаются в практике врача любой специальности. Следовательно, наследственная патология может быть классифицирована в соответствии с потребностями конкретных медицинских специальностей, она ничем не отличается от классификаций болезней по органному, системному принципу или по типу обмена веществ. Поскольку наследственные болезни едины по этиологическому принципу (мутации), то основу их классификации составляет прежде всего системный и органный принцип: нервные, нервно-мышечные, психические, болезни опор-
Часть I. ОБЩАЯ НОЗОЛОГИЯ

|
| Рис. 22. Множественный нейрофибриоз (по К. Kawashima, 1911) |
но-двигательного аппарата, кожи, зубо-челюст-ной системы, крови и др. Естественно, что такой подход не однозначен. Например, нейрофиб-роматоз (доминантная мутация) встречается и в нейрохирургических (у больных развиваются опухоли мозга), и в клиниках кожных болезней, поскольку у этих больных первоначально появляются светло-коричневые обширные пятна и неирофиброматозные узелки на коже, и в клиниках нервных болезней в связи с глубокими нейрофибромами (рис. 22). Больные с хореей Гентингтона являются пациентами и невропатолога, и психиатра; больные с гепатолентикуляр-ной дегенерацией - и терапевта, и невропатолога. Можно найти очень немного наследственных болезней, при которых избирательно поражается одна система. Даже моногенно детерминируемые болезни вследствие плейотропного действия гена и вторичных патогенетических факторов затрагивают разные органы и системы. Большинство генных мутаций, а тем более хромосомные и геномные, вызывают генерализованное повреждение какой-либо ткани (например, болезни соединительной ткани) или захватывают несколько органов. Вот почему многие наследственные болезни проявляются в виде синдромов или комплекса патологических признаков, на первый взгляд не связанных между собой.
В основе классификации наследственных болезней, проявляющихся в нарушении обмена веществ, лежат типы повреждения первичного звена обмена. Такая биохимическая классификация как бы объединяет генетический и патофизиологический (клинический) подход. По такому принципу различают наследственные болезни обмена углеводов, липидов, аминокислот, витаминов, пуринов и пиримидинов, биосинтеза гормонов и т.д.
Многочисленные клинические классификации наследственных заболеваний различных органов, систем организма и видов нарушения обмена веществ объединены главным общим свойством - они являются описательными, а потому часто изменяющимися как по структуре построения, так и по содержанию (включения или исключения тех или иных форм патологии). Накопленные наукой и медицинской практикой сведения о генетических основах болезней человека позволяют предложить рабочую классификацию:
|
|