
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Инструментальные методы анализа
|
|
В последние годы все более широкое применение получают инструментальные метода анализа, обладающие многими достоинствами: быстротой анализа, высокой чувствительностью, возможностью одновременного определения нескольких компонентов, сочетания нескольких методов, автоматизации и использования компьютеров для обработки результатов анализа. Как правило в инструментальных методах анализа применяются сенсоры (датчики), и прежде всего химические сенсоры, которые дают информацию о составе среды, в которой они находятся. Сенсоры связаны с системой накопления и автоматической обработки информации. Важнейшие методы инструментального анализа были перечислены в табл. 16.1. Подробное рассмотрение инструментальных методов анализа выходит за пределы данного курса. Это предмет аналитической химии. Остановимся на некоторых методах, основанных на законах и принципах, рассмотренных ранее. Электрохимические методы. К наиболее применимым электрохимическим методам анализа относятся потенциометрический, полярографический и кондуктометрический.
Потенциометрический метод базируется на измерении электродных потенциалов, которые зависят от активности ионов, а в разбавленных растворах - от концентрации ионов. Потенциалы металлических электродов определяются уравнением Нернста (уравнение 9.10)
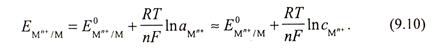
Соответственно по значению потенциала можно судить о концентрации ионов. Измерительная ячейка состоит из измерительного (индикаторного) электрода и электрода сравнения, который не чувствителен к определяемому веществу.
Все более широкое применение находят ионселективные электроды, на границах раздела фаз которых протекают ионообменные реакции. Потенциал ионселективного электрода зависит от активности, а в разбавленных растворах - от концентрации ионов в соответствии с уравнением Нернста (уравнение 9.10). Наиболее широко известны ионселективные стеклянные электроды для измерения рН. На поверхности стеклянного электрода происходит реакция ионного обмена
Ktст+ + Hр+ → ← Нcт+ + Кtр+,
Кtст - катионы стекла (К+, Nа+, Li+), индекс р означает раствор.
На границе стекла и раствора возникает скачок потенциала, величина которого зависит от активности ионов водорода

Измерительная ячейка со стеклянным и вспомогательным электродами соединена с прибором рН-метром, предназначенным для измерения рН растворов.
Промышленностью также выпускаются ионселективные электроды для определения концентрации ионов Nа+, К+, NН4, Сl- (предел определения 10-1 - 10-6 моль/л) и ионов Са2+, Мg +, NО3- (предел определения 10-1 - 10-4 моль/л).
Полярографический метод предложен чешским ученым Я.Гейеровским в 1922 г. В этом методе строят кривые напряжение - ток для ячейки, у которой два, обычно ртутных, электрода. Один электрод капающий, второй электрод неподвижный с большой площадью поверхности. В ячейку заливается анализируемый раствор. При прохождении тока анализируемый ион осаждается на капле ртути и растворяется в этой капле:
М n ++ nе + Нg = М (Нg)
Напряжение ячейки определяется, прежде всего, потенциалом капающего электрода, на котором возникает значительная концентрационная поляризация, так как он имеет небольшую площадь поверхности и соответственно высокую плотность тока. Восстановление его ионов протекает в режиме предельного тока, которое для капающего электрода имеет выражение:
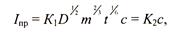 (16.3)
(16.3)
где К1 и К2 - константы; D - коэффициент диффузии; m - масса капли ртути; t - время образования капли; с - концентрация анализируемого металла в растворе.
Потенциал ртутного электрода определяется природой разряжающихся ионов и током, зависящим от концентрации ионов:
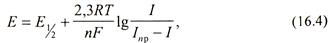
где Е 1/2 - потенциал полуволны, определяемый природой ионов; I - ток, I пр - предельный ток (уравнение 16.3).
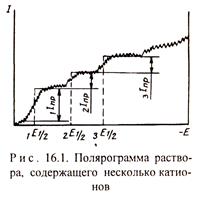
Если в растворе присутствует один разряжающийся ион, то полярографическая кривая (пoлярограмма) имеет одну волну, при наличии нескольких ионов - несколько волн (рис. 16.1). По значению потенциала полуволны определяется вид ионов, а по величине предельного тока - их концентрация. Таким образом, полярографический метод позволяет определять концентрацию нескольких ионов в растворе.
Кондуктометрия. Электрическая проводимость разбавленных растворов пропорциональна концентрации электролитов. Поэтому, определив электрическую проводимость и сравнив полученное значение со значением на калибровочном графике, можно найти концентрацию электролита в растворе. Методом кондуктометрии, например, определяют общее содержание примесей в воде высокой чистоты.
Хроматографический анализ. Анализ основан на хроматографии, позволяющей разделять двух- и многокомпонентные смеси газов, жидкостей и растворенных веществ методами сорбции в динамических условиях. Анализ производится с помощью специальных приборов - хроматографов. Разработано несколько методов анализа, которые классифицируются по механизму процесса и природе частиц (молекулярная, ионообменная, осадительная, распределительная хроматография) и по формам применения (колоночная, капиллярная, тонкослойная и бумажная). Молекулярная хроматография основана на различной адсорбируемости молекул на адсорбентах, ионообменная хроматография - на различной способности к обмену ионов раствора. В осадительной хроматографии используется различная растворимость осадков, образуемых компонентами анализируемой смеси при взаимодействии с реактивами, нанесенными на носитель. Распределительная хроматография базируется на различном распределении веществ между двумя несмешивающимися жидкостями. Молекулярная (жидкостная адсорбционная), ионообменная и осадительная хроматография обычно проводятся в хроматографических колонках соответственно с адсорбентом, ионообменным материалом или инертным носителем с реагентом. Распределительная хроматография, как правило, выполняется на бумаге или в тонком слое абсорбента.
К достоинствам хроматографического метода анализа относятся быстрота и надежность, возможность определения нескольких компонентов смеси или раствора.
Оптические методы анализа. Эти методы основаны на измерении оптических свойств веществ и излучений, взаимодействия электромагнитного излучения с атомами или молекулами анализируемого вещества, вызывающего излучение, поглощение или отражение лучей. Они включают в себя эмиссионные, люминесцентные и абсорбционные спектральные методы.
Методы, основанные на изучении спектров излучения получили название эмиссионных спектральных методов анализа. В методе эмиссионной спектроскопии проба вещества нагревается до очень высоких температур (2000 - 15000°С). Вещество, испаряясь, диссоциирует на атомы или ионы, которые дают излучение. Проходя через спектрограф, излучение разлагается на компоненты в виде спектра цветных линий. Сравнение этого спектра со справочными данными о спектрах элементов позволяет определить вид элемента, а по интенсивности спектральных линий – количество вещества. Метод дает возможности определять микро- и ультрамикро-количества вещества, анализировать несколько элементов, причем за короткое время.
Разновидностью эмиссионного анализа является эмиссионная пламенная фотометрия, в которой исследуемый раствор вводят в бесцветное пламя горелки. По изменению цвета пламени судят о виде вещества, а по интенсивности окрашивания пламени - о концентрации вещества. Анализ выполняют с помощью прибора -пламенного фотометра. Метод в основном используется для анализа щелочных, щелочно-земельных металлов и магния.
Методы, основанные на свечении анализируемого вещества под воздействием ультрафиолетовых (фотолюминесценция), рентгеновских (рентгенолюминесценция) и радиоактивных (радиолюминесценция) лучей называются люминесцентными. Некоторые вещества обладают люминесцентными свойствами, другие вещества могут люминесцировать после обработки специальными реактивами. Люминесцентный метод анализа характеризуется очень высокой чувствительностью (до 10–10 – 10–13 г люминесцирующих примесей).
Методы, основанные на изучении спектров поглощения лучей анализируемыми веществами, получили название абсорбционно-спектральных. При прохождении света через раствор свет или его компоненты поглощаются или отражаются. По величине поглощения или отражения лучей судят о природе и концентрации вещества.
В соответствие с законом Бугера–Ламберта–Бера зависимость изменения интенсивности потока света, прошедшего через раствор, от концентрации окрашенного вещества в растворе с, выражается
уравнением
lg(I 0/ I)=ε lc (16.5)
где I 0 и I - интенсивность потока света, падающего на раствор и прошедшего через раствор; ε - коэффициент поглощения света, зависящий от природы растворенного вещества (молярный коэффициент поглощения); l - толщина слоя светопоглощающего раствора.
Измерив изменение интенсивности потока света, можно определить концентрацию анализируемого вещества. Определение ведут с помощью спектрофотометров и фотоколориметров.
В спектрофотометрах используют монохроматическое излучение, в фотоколориметрах - видимый свет. Сравнивают полученные при измерении данные с градуированными графиками, построенными на стандартных растворах.
Если измеряют поглощение лучей атомами определяемого компонента, которые получают распылением раствора анализируемого вещества в пламени горелки, то метод называют атомно-абсорбционным (атомно-абсорбционная спектроскопия). Метод позволяет анализировать вещества в очень малых количествах.
Оптический метод, основанный на отражении света твердыми частицами, взвешенными в растворе, называется нефелометрическим. Анализ проводится с помощью приборов нефелометров.
Таким образом, использование законов электрохимии, сорбции, эмиссии, поглощения или отражения излучения и взаимодействия частиц с магнитными полями, позволило создать большое число инструментальных методов анализа, характеризуемых высокой чувствительностью, быстротой и надежностью определения, возможностью анализа многокомпонентных систем.
Вопросы и задачи для самоконтроля
9. Какие принципы лежат в основе потенциометрического и полярографического методов анализа?
10. Если концентрация ионов а) Аg+, б) Zn2+, в) Вi3+ уменьшилась на порядок,
то как изменились потенциалы электродов?
11. В чем различие принципов эмиссионного спектрального и абсорбционного спектрального методов анализа?
|
|