
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая идентификация и анализ вещества
|
|
Общие понятия. Химическая идентификация (обнаружение) - это установление вида и состояния фаз, молекул, атомов, ионов и других составных частей вещества на основе сопоставления экспериментальных и соответствующих справочных данных для известных веществ. Идентификация является целью качественного анализа. При идентификации обычно определяется комплекс свойств веществ: цвет, фазовое состояние, плотность, вязкость, температуры плавления, кипения и фазового перехода, растворимость, электродный потенциал, энергия ионизации и (или) др. Для облегчения идентификации созданы банки химических и физико-химических данных. При анализе многокомпонентных веществ все более используются универсальные приборы (спектрометры, спектрофотометры, хроматографы, полярографы и др.), снабженные компьютерами, в памяти которых имеется справочная химико-аналитическая информация. На базе этих универсальных установок создается автоматизированная система анализа и обработки информации.
В зависимости от вида идентифицируемых частиц различают элементный, молекулярный, изотопный и фазовый анализы.
В зависимости от массы сухого вещества или объема раствора анализируемого вещества различают макрометод (0, 5 - 10 г или 10 -100 мл), полу микрометод (10 - 50 мг или 1 - 5 мл), микрометод (1-5 мг или 0, 1 - 0, 5мл) и ультрамикрометод (ниже 1 мг или 0, 1 мл) идентификации.
Качественный анализ характеризуется пределом обнаружения (обнаруженным минимумом) сухого вещества, т.е. минимальным количеством надежно идентифицируемого вещества, и предельной концентрацией раствора с х min. Эти две величины связаны друг с другом соотношением
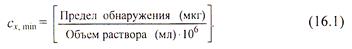
В качественном анализе применяются только такие реакции, пределы обнаружения которых не превышают 50 мкг.
Имеются некоторые реакции, которые позволяют обнаружить то или иное вещество или ион в присутствии других веществ или других ионов. Такие реакции называются специфическими. Примером таких реакций могут быть обнаружение ионов МНз действием щелочи или нагреванием
NH4С1 + NаОН = NH3 ↑ + H2O + NaCl
реакция иода с крахмалом с темно-синим окрашиванием, обнаружение NО-2 с помощью реакции со смесью сульфаниловой кислоты Н[SОзС6Н4NН2] и α -нафтиламина С10Н7NН2, в результате которой появляется красное окрашивание.
Однако в большинстве случаев реакции обнаружения вещества не являются специфическими, поэтому мешающие идентификации вещества переводят в осадок, слабодиссоциирующее или комплексное соединение. Анализ неизвестного вещества проводят в определенной последовательности, при которой то или иное вещество идентифицируют после обнаружения и удаления, мешающих анализу других веществ, т.е. применяют не только реакции обнаружения веществ, но и реакции отделения их друг от друга.
Так как свойства вещества зависят от его чистоты, необходимо кратко остановиться на этом вопросе.
Чистота веществ. Элементное вещество или соединение содержит основной (главный) компонент и примеси (посторонние вещества). Если примеси содержатся в очень малых количествах, то их называют «следами». Термины отвечают молярным долям в %: «следы» 10-3 ÷ 10-1, «микроследы» - 10-6 ÷ 10-3, «ультрамикроследы» - 10-9 ÷ 10-6, субмикроследы - менее 10-9. Вещество называется высокочистым при содержании примесей не более 10-4 ÷ 10-3 % (мол. доли) и особо чистым (ультрачистым) при содержании примесей ниже 10-7 % (мол. доли). Имеется и другое определение особо чистых вещества, согласно которому они содержат примеси в таких количествах, которые не влияют на основные специфические свойства веществ. Так согласно этому определению особо чистые редкоземельные металлы содержат примесей не более 10-1 % (ат. доли), в то время как особо чистый (полупроводниковый) германий - не более 10-7 % (ат. доли). Поэтому значение имеет не любая примесь, а примеси, оказывающие влияние на свойства чистого вещества. Такие примеси называются лимитирующими или контролирующими примесями.
Следует отметить, что определение степени чистоты часто зависит от наименьшей суммарной концентрации примесей, которую удается обнаружить. Например, спектрально чистыми называют вещества, примеси в которых можно определить спектральными методами.
В нашей стране особо чистым веществам присваиваются определенные марки, которыми характеризуют число видов и логарифм массовой доли лимитирующих примесей (%). Например, марка ОСЧ8-6 означает, что вещества особой чистоты содержит 8 лимитирующих видов примесей, причем суммарная их концентрация не превышает 10-6 % (масс, долей). При наличии органических примесей их обозначают индексом «ОП» и указывают логарифм их массовой доли (%). Например, марка ОП-5-ОСЧ означает, что суммарное содержание органических примесей не превышает Ю-5 % (массовых долей).
Идентификация катионов неорганических веществ. Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения, происходит окисление или восстановление с изменением цвета раствора.
Для идентификации с помощью образования труднорастворимых соединений используют как групповые, так и индивидуальные осадители. Групповыми осадителями для ионов Аg+, Рb2+, Нg2+ служит NaCl; для ионов Са2+, Sг2+, Ва2+ - (NН4)2СО3, для ионов А13+, Сг3+, Fе2+, Fе3+, Мn2+, Со2+, Ni2+, Zn2+ и др. - (NH4)2S.
Если присутствует несколько катионов, то проводят дробный анализ, при котором осаждаются все труднорастворимые соединения, а затем обнаруживаются оставшиеся катионы тем или иным методом, либо проводят ступенчатое добавление реагента, при котором сначала осаждаются соединения с наименьшим значением ПР, а затем соединения с более высоким значением ПР.
Любой катион можно идентифицировать с помощью определенной реакции, если удалить другие катионы, мешающие этой идентификации. Имеется много органических и неорганических реагентов, образующих осадки или окрашенные комплексные соединения с катионами (табл. 16.1).
Летучие соединения металлов окрашивают пламя горелки в тот или иной цвет. Поэтому, если внести изучаемое вещество на платиновой или нихромовой проволоке в бесцветное пламя горелки, то происходит окрашивание пламени в присутствии в веществе тех или иных элементов, например, в цвета: ярко-желтый (натрий), фиолетовый (калий), кирпично-красный (кальций), карминово-красный (стронций), желто-зеленый (медь или бор), бледно-голубой (свинец или мышьяк).

Идентификация анионов. Анионы обычно классифицируют по растворимости солей, либо по окислительно-восстановительным свойствам. Так многие анионы (SO2-4, SО32-, СО2-3, SiO32-, F-, РО3-4, СгО2-4 и др.) имеют групповой реагент ВаС12 в нейтральной или слабо кислой среде, так как соли бария и этих анионов мало растворимы в воде. Групповым реагентом в растворе НNО3 на ионы Сl-, Вг-, I-, SCN-, СN-, S2-, СlO-, [Fе(СN)6]4- и др. служит АgNО3. Классификация анионов по окислительно-восстановительным свойствам приведена в табл. 16.2.
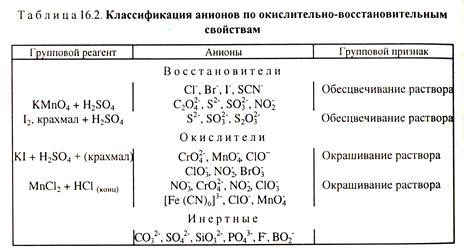
Анионы можно обнаружить дробным анализом. Для этого групповой реагент ступенчато приливают к анализируемому раствору, первыми выпадают в осадок соединения с наименьшими значениями ПР. Отдельные ионы могут быть обнаружены с помощью тех или иных специфических реакций или реагентов. Например, при воздействии на анионы СО2-3 кислотой протекает реакция с выделением пузырьков диоксида углерода:
СО32- + 2Н+ → ← Н2СО3 → ← Н2О + СО2
Как и для катионов, имеются реагенты на те или иные анионы (табл. 16.3).
Таким образом, химическая идентификация вещества базируется в основном на реакциях осаждения, комплексообразования, окисления и восстановления, нейтрализации, при которых происходит выпадение белого или окрашенного осадка, изменение цвета раствора или выделение газообразных веществ.

Вопросы и задачи для самоконтроля
1. Какой раздел химии имеет задачу идентификации веществ? Какие свойства веществ определяются при идентификации?
2. Вычислите предел обнаружения вещества, если предельная концентрация составляет 10-7 моль/л, а объем раствора - 20 мл.
3. Обнаружатся ли ионы кальция в 90 мл раствора, содержащего 110 мг СаС12, при добавлении к нему 10 мл раствора (NН4)2С03, имеющего концентрацию: а) 10-2 моль/л; б) 1 моль/л?
|
|