
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Инициация
|
|
Точка начала репликации ДНК E. coli, обозначаемая oriC, включает 245 пар оснований: локус ori включает элементы ДНК-последовательностей, которые являются высококонсервативными для всех точек начала репликации у бактерий. Общее расположение консервативных последовательностей приведено на рис. 2.
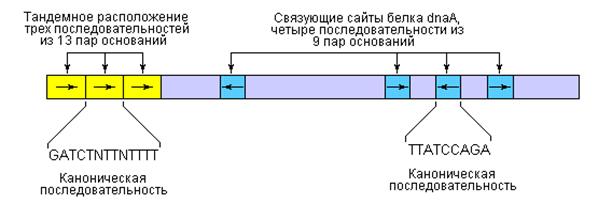
| Рис. 2 | Порядок расположения консервативных последовательностей в точке начала репликации хромосомы E. coli – oriC. Несмотря на то, что повторяющиеся последовательности не совсем идентичны, некоторые нуклеотиды проявляют высокую степень консервативности по отношению к определенным положениям, формируя общую последовательность. В тех положениях, где отсутствует полное совпадение, символ N означает присутствие любого из четырех нуклеотидов. Стрелками показаны ориентации нуклеотидных последовательностей. |
Ключевые последовательности в области точки начала репликации представлены двумя сериями повторов: тремя повторами из 13 пар оснований и четырьмя повторами из 9 пар оснований. Как следует из табл. С в фазе инициации репликации принимают участие, по меньшей мере, 9 различных ферментов и белковых факторов. Эти ферменты и белки раскрывают спираль ДНК в точке начала репликации и формируют предзатравочный комплекс. Ключевым компонентом инициации является белок dnaA.
Таблица С
Белки, необходимые для инициации репликации хромосомы E. coli в локусе oriC
| Белок | Молекулярная масса | Число субъединиц | Функция |
| Белок dnaA | 52.000 | Узнает специфические последовательности oriC. Открывает дуплекс ДНК в локусе ori. | |
| Белок dnaB (геликаза) | 300.000 | 6* | Разделяет цепи ДНК |
| Белок dnaC | 29.000 | Участвует в связывании dnaB в точке начала репликации | |
| HU | 19.000 | Гистоноподобный белок; ДНК-связывающий белок; стимулирует инициацию репликации | |
| Белок dnaG (праймаза) | 60.000 | Синтезирует РНК-праймеры | |
| SSB-белок | 75.600 | 4* | Связывается с одноцепочечным участком ДНК |
| РНК-полимераза | 454.000 | Усиливает активность dnaA | |
| ДНК-гираза (ДНК-топоизомераза II) | 400.000 | 4 | Устраняет топологические напряжения, возникающие в ДНК в результате разделения ее цепей |
| Dam-метилаза | 32.000 | Метилирует последовательности (5/)GATC в точке начала репликации |
* в указанных случаях субъединицы идентичны
Белковый комплекс из 4-5 молекул инициаторного белка dnaA взаимодействует с каждым из четырех повторов из 9 пар оснований в точке начала репликации и обеспечивает плавление ДНК в области трех повторов из 13 пар оснований, которая обогащена А-Т парами. Этот процесс требует участия АТР и бактериального гистоноподобного белка HU. После этого белок dnaC обеспечивает взаимодействие белков dnaВ с денатурированной областью ДНК. Белки dnaВ в виде кольцеобразных гексамеров связываются с каждой цепью ДНК и действуют как геликазы расплетая двойную спираль и формируя две потенциальные репликативные вилки. Если при этом в условиях in vitro в систему репликации добавить SSB-белки и ДНК-топоизомеразу II (ДНК-гиразу) E. coli dnaВ-геликазы с большой скоростью начнут разделять тысячи пар оснований двигаясь в противоположных направлениях от точки начала репликации. Множество молекул SSB-белков кооперативно связываются с одноцепочечной ДНК стабилизируя одиночные цепи и препятствуя их ренатурации в то время как гираза устраняет топологическое напряжение индуцируемое dnaВ-геликазой. После добавления в систему репликации E. coli in vitro дополнительных ферментов dnaВ-зависимый процесс разделения цепей становится сопряженным с собственно удвоением ДНК.
Фаза инициации репликации ДНК, как известно, является единственной стадией всего процесса, которая регулируется, причем регулируется, так что удвоение ДНК происходит только один раз в каждом клеточном цикле. В целом механизм регуляции репликации все еще мало понятен, однако результаты ряда генетических и биохимических исследований проливают некоторый свет на основы такой регуляции.
В частности установлено, что на выбор времени начала репликации влияет метилирование ДНК и ее взаимодействие с бактериальной плазматической мембраной. Участок ДНК, в составе локуса oriC, метилируется специфической Dam-метилазой ( D NA a denine m ethylation), которая вводит метильную группу по N6-положению аденина в составе короткого палиндрома (5/)GATC. Следует отметить, что локус oriC E. coli чрезвычайно обогащен последовательностями GATC – в составе 245 пар оснований их насчитывается 11, в то время как средняя встречаемость GATC в хромосоме кишечной палочки не превышает 1 на 256 пар оснований.
В норме GATC-палиндромы в локусе oriC полностью метилированы. Сразу после удвоения ДНК в точке начала репликации данные участки становятся полуметилированными: родительские цепи остаются метилированными по последовательностям GATC, но вновь синтезированныее дочерние цепи ДНК имеют неметилированные сайты в последовательности GATC. Полуметилированное состояние локуса oriC становится сигналом для его взаимодействия с плазматической мембраной бактериальной клетки и соответственно изолирования этой точки начала репликации от повторной ее активации (правда механизм такого взаимодействия пока не известен). Спустя определенное время последовательность oriC высвобождается из взаимодействия с плазматической мембраной и снова полностью метилируется с участием Dam-метилазы, получая, тем самым, возможность повторно связывать белки dnaA, а, следовательно, активироваться для следующего цикла репликации. В регуляции инициации репликации также определенную роль играет процесс медленного гидролиза АТР под действием белка dnaA, который включается в циклическое превращение его активной (с АТР) и неактивной форм (без АТР) происходящее в интервале времени от 20 до 40 мин.
Элонгация
Стадия элонгации в ходе репликации ДНК включает два различных, но взаимосвязанных процесса: синтез лидирующей цепи и синтез отстающей цепи. Определенный набор ферментов и вспомогательных белков, действующих в области репликативной вилки, является общим для синтеза обеих цепей. К ним относятся ДНК-геликазы, ДНК-топоизомеразы и SSB-белки. Так, ДНК-геликазы разделяют материнские цепи исходной ДНК, ДНК-топоизомеразы устраняют топологическое напряжение, генерируемое геликазами, а SSB-белки стабилизируют разделенные одиночные материнские цепи. Начиная с момента стабилизации разделенных одиночных материнских цепей, процессы синтеза лидирующей и отстающей дочерних цепей приобретают существенные различия.
Синтез лидирующей цепи начинается с образования в точке начала репликации короткого (10-60 нуклеотидов) РНК-праймера под действием праймазы – белка dnaG. Затем синтез лидирующей цепи происходит непрерывно путем добавления дезоксинуклеотидов к 3/-концу праймера под действием ДНК-полимеразы III. В противоположность лидирующей цепи, синтез отстающей цепи осуществляется посредством периодического образования достаточно коротких ДНК-фрагментов, называемых фрагментами Оказаки. В этом случае сначала под действием праймазы также синтезируется РНК-праймер и ДНК-полимераза III начинает добавлять к нему дезоксинуклеотиды, синтезируя фрагмент Оказаки. При всей кажущейся простоте образования каждого отдельного фрагмента Оказаки в целом процесс синтеза ДНК требует решения важной «пространственной задачи» связанной с необходимостью преодоления проблемы антипараллельности цепей исходной молекулы и ее согласования с естественным свойством всех ДНК-полимераз – неспособностью данных ферментов присоединять нуклеотиды к 5/-концам праймеров. Суть решения данной проблемы заключается в необходимости координации образования лидирующей и отстающей цепей. Действительно, синтез обеих цепей происходит с участием одного единственного (в одной репликативной вилке) асимметрического димера ДНК-полимеразы III, который обеспечивает сближение двух точек полимеризации. Такая ситуация может быть реализована в случае образования «петли» на отстающей цепи как это показано на рис. 3.
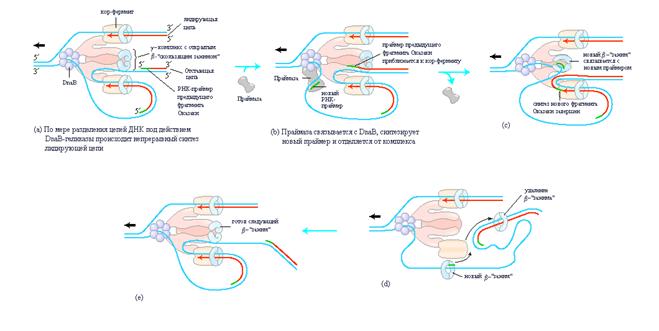
| Рис. 3 | Синтез лидирующей и отстающей цепей ДНК. События в области одной репликативной вилки скоординированы одним единственным асимметрическим димером ДНК-полимеразы III в комплексе с dnaB-геликазой. На рисунке показан уже происходящий процесс репликации. Отстающая цепь образует петлю и взаимодействует с ДНК-полимеразой III так, что синтез лидирующей и отстающей цепей происходит одновременно. Красной стрелкой показаны 3/-концы двух новых цепей и одновременно направление синтеза ДНК. Черные стрелки показывают направление движения родительской ДНК через полимеразный комплекс. Показано образование фрагментов Оказаки на отстающей цепи. |
Синтез фрагментов Оказаки на отстающей цепи представляет собой в некоторой степени элегантную «ферментативную хореографию». Белки dnaВ-геликаза и dnaG-праймаза являются составными частями комплекса называемого праймосомой, который формируется вслед за образованием предзатравочного комплекса в результате связывания с dnaВ-геликазой белка dnaG-праймазы. Для осуществления репликации ДНК-полимераза III использует один набор субъединиц кор-фермента для непрерывного синтеза лидирующей цепи, тогда как другой набор субъединиц кор-фермента осуществляет циклическое образование фрагментов Оказаки. dnaВ-геликаза расплетает двойную спираль ДНК в репликативной вилке (рис. 3-а) по мере своего АТР-зависимого перемещения по отстающей цепи в направлении 5/®3/. ДНК-праймаза время от времени связывается с dnaВ-геликазой и синтезирует короткий РНК-праймер (рис. 3-b). После этого новый «скользящий зажим», обозначаемый b позиционируется на праймере с помощью g-комплекса ДНК-полимеразы III (рис. 3-c). По завершению синтеза фрагмента Оказаки репликация приостанавливается, и субъединицы кор-фермента ДНК-полимеразы отделяются от «скользящего зажима» (и от фрагмента Оказаки) и взаимодействуют с новым «скользящим зажимом» (рис. 3-d, e). Описанные выше события инициируют синтез следующего фрагмента Оказаки. В целом, весь набор ферментов, действующий в области репликативной вилки, называют реплисомой. Характеристика ферментов реплисомы приводится в табл. D.
Реплисома способна поддерживать высокую скорость синтеза ДНК, присоединяя около 1.000 нуклеотидов в сек к каждой растущей цепи. После образования фрагмента Оказаки тот РНК-праймер, который служил основой для его синтеза, удаляется под действием РНК-азы Н и пробел заполняется соответствующим участком ДНК с помощью ДНК-полимеразы I, а остающаяся брешь «залечивается» ДНК-лигазой.
ДНК-лигаза катализирует формирование фосфодиэфирной связи 3/-гидроксильным концом одной цепи и 5/-фосфатным концом другой. Лигазная реакция протекает только в том случае если 5/-концевая фосфатная группа активирована аденилированием. Для этой цели вирусы и эукариоты используют АТР. В тоже время бактериальные ДНК-лигазы в большинстве случаев для активации 5/-концевых фосфатных групп используют АМР являющийся компонентом NAD+. Кроме процесса репликации ДНК ДНК-лигазы также принимают участие в рекомбинации и репарации этой информационной молекулы, а также находят широкое применение в генно-инженерных работах при получении рекомбинантных ДНК.
|
|