
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
УДК 547 5 страница
|
|
д) 1-метилизохинолин; е) тетрагидрофуран;
ж) 2-метилпиридин; з) 3-(2-аминоэтил)индол;
и) хинолин-4-карбоновая кислота; к) 7-метокситриптамин;
л) 2-метилпиримидин; м) 3-метилиндол;
н) тиофен-2-сульфокислота; о) 2-аминопиридин;
п) 1-фенил-3-метилпиразолон-5;
р) 3-(1-метилпирролидил-2)-пиридин;
с) 2, 4-диметил-3, 5-дикарбэтоксипиррол.
2. Сравните на примере галогенирования (например, йодирования) реакционную способность ядра пиррола, тиофена, бензола и пиридина.
3. Никотин – алкалоид (сильно ядовитое вещество, широко используемое для борьбы с вредными насекомыми):

Укажите типы гетероциклов в этом соединении. Рассмотрите электронные эффекты обоих атомов азота, сравните их основность. Напишите реакции никотина с: а) HCl, б) Cl2 при УФ-облучении.
4. Укажите промежуточные продукты в синтезе поли-N-винилпирролидона (синтетического заменителя плазмы крови).
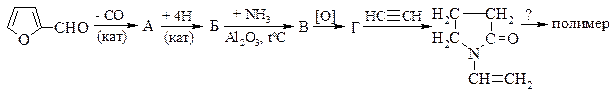
5. Изомерные хлорпиридины заметно различаются по способности обменивать хлор на нуклеофильные группы. Так, 2- и 4-хлорпиридины легко реагируют с водой, образуя соответствующие оксипиридины. В то же время 3-хлорпиридин стабилен не только в сходных, но и в более жестких условиях. В чем причина такого разного поведения хлорпиридинов?
6. Укажите структурные формулы всех продуктов, образующихся при взаимодействии хинолина со следующими реагентами (в том случае, если реакция протекает вообще; если нет – укажите).
а) Br2, 240°C; б) H2SO4, 240°C; в) PhCOCl, AlCl3;
г) PhCl, AlCl3; д) C2H5Br; е) PhMgBr, 20°C;
ж) HNO3, разб.; з) KOH конц.; и) PhCO3H;
к) H2/Pt; л) PhN2+Clˉ; м) SO3, 20°C;
н) KMnO4, H+, t°C; о) NaNH2, t°C; п) NaNO2, H+.
7. Замените знак «?» в схемах на структурные формулы в следующей цепи превращений:
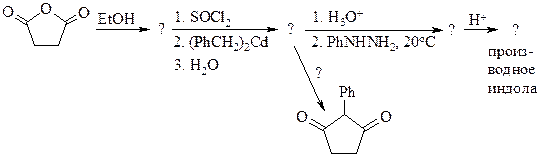
8. Предложите метод синтеза из неорганических соединений: а) 3, 4-дифенилтиофена; б) 2, 5-дифенилпиррола; в) 1, 3, 5-триметилиндола; г) 7-фторхинолина; д) 1-бензилизохинолина – структурного аналога папаверина (одного из алкалоидов опия).
9. Предложите метод синтеза 1, 4-диметилизохинолина с использованием бензола, уксусной кислоты и неорганических реагентов и укажите строение продукта его взаимодействия с бензальдегидом в присутствии щелочи при нагревании.
10. Напишите структуры А-Е в синтезе лекарственного препарата бутадиона:
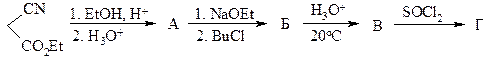

11. Предложите метод синтеза приведенного ниже соединения из бензола и любых органических соединений, в состав которых входят 1-2 атома углерода.
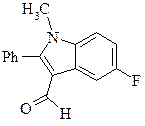
Назовите его по номенклатуре ИЮПАК.
12. Какие дикарбонильные соединения надо взять, чтобы при дегидратации (либо совместной дегидратации с аммиаком или амином) получить следующие вещества: а) 2, 5-диметилфуран; б) 3, 4-диметилпиррол; в) 1, 2, 5-триметилпиррол?
13. Какие дикарбонильные соединения надо использовать, чтобы при их гетероциклизации получить: а) 2, 4-диметилтиофен; б) 2, 3, 5-трифенилтиофен?
14. Какие исходные арилгидразины и оксосоединения надо взять, чтобы с помощью реакции Фишера получить следующие соединения:


15. Как с помощью реакции Юрьева получить из сильвана (2-метилфурана) 2-метилтиофен, α -метилпиррол, 1-фенил-2-метилпиррол?
16. При нагревании кротонового альдегида с анилином в присутствии серной кислоты образуется хинальдин. Напишите схему реакции. Какие исходные вещества надо взять, чтобы аналогично синтезировать 3-метил-2-этил-6-метоксихинолин?
17. Назовите промежуточные продукты при синтезе гетероауксина:
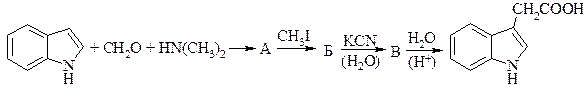
18. Предложите метод синтеза соединения А из бензола, метанола и этанола. Изобразите структуру продукта взаимодействия А с диметилацетилендикарбоксилатом.
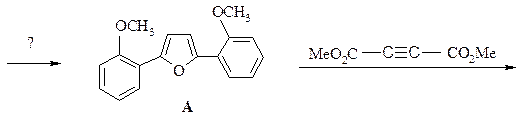
19. В распоряжении имеются тиофен, фуран, этилацетат и другие необходимые реагенты. Получите замещенный пиридин:
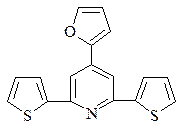
20. Расшифруйте схему превращений:
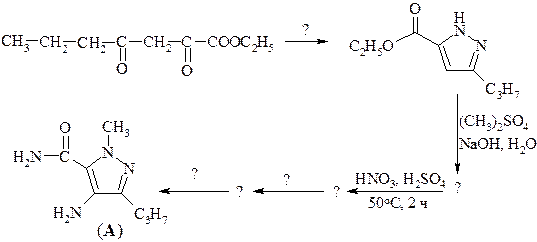

21. АМИНОКИСЛОТЫ. БЕЛКИ
1. Напишите уравнения реакций и назовите образующиеся соединения: β -фенил-α -аланина с пятихлористым фосфором, серина с гидроксидом калия, глицина с избытком йодистого метила, окисления цистеина кислородом воздуха, разложения 4-аминогексановой кислоты при нагревании, восстановления β -аминопропионовой кислоты алюмогидридом лития.
2. Напишите схему синтеза аспарагиновой кислоты фталимидмалоновым методом:

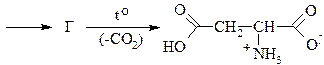
3. Напишите схему синтеза метионина из малонового эфира:
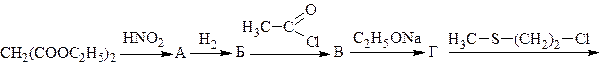
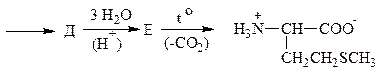
4. Охарактеризуйте отношение к нагреванию α -, β - и γ -аминокислот. Три изомерные аминокислоты А, Б и В (С5Н11О2N) при нагревании превращаются в А ', Б ', B '. Вещество А ' – диизопропильное производное дикетопиперазина; образование продукта Б ' сопровождается выделением газа; озонолиз Б ' дает глиоксалевую кислоту и пропаналь; вещество В ' представляет собой γ -лактам (γ -метилпирролидон). Каково строение упомянутых выше веществ?
5. Приведите строение глицилсерилгистидина, представляющего собой трипептидный участок инсулина. Укажите в нем пептидные связи, N- и С-концы.
6. Самым сладким из известных в настоящее время веществ является дипептид, состоящий из остатка L-аспарагиновой кислоты и остатка аминомалоновой кислоты, одна из карбоксильных групп которой входит в состав метилового эфира, другая – фенхилового эфира:
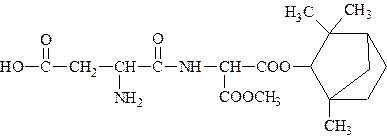
Соединение слаще сахара в 33000 раз, для придания вкуса пищевым продуктам его добавляют в долях миллиграмма. Напишите схему полного гидролиза дипептида при нагревании в кислой среде.
7. Определите последовательность аминокислот в гексапептиде по следующим результатам его превращений:
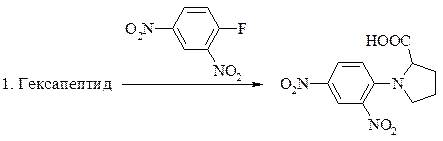
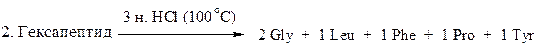
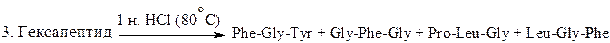
8. При гниении белков под действием микроорганизмов образуются диамины – путресцин (бутандиамин-1, 4) и кадаверин (пентандиамин-1, 5). Из каких α -аминокислот и в результате каких реакций получаются эти диамины?
9. Напишите формулу трипептида и назовите его, если при его деградации получены фенилтиогидантоиновые производные в последовательности:
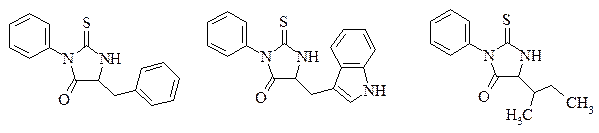
10. Используя стандартный метод защиты аминогруппы и активации карбоксильной группы, синтезируйте Asp-Phe; Ile-Thr; Val-Leu; Tyr-Ser.
11. ПАСК (п -аминосалициловая кислота) – антитуберкулезный препарат:
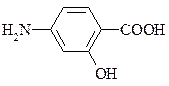
Укажите реакционный центр в молекуле ПАСК при ее взаимодействии с: а) HCl, б) NaHCO3, в) FeCl3, г) HNO2. Рассмотрите электронные эффекты заместителей в бензольном кольце. Каково суммарное влияние всех заместителей на направление реакций электрофильного замещения?
12. Напишите формулы веществ в следующих схемах:
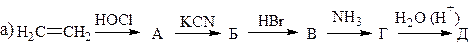
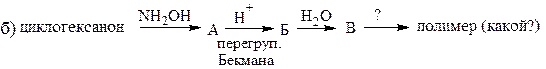
13. Установите строение вещества С3Н7О2N, которое обладает амфотерными свойствами, при реакции с HNO2 выделяет азот, с этиловым спиртом образует соединение С5Н11О2N, а при нагревании переходит в вещество состава С6Н10О2N2.
14. При полном кислотном гидролизе некоторого пентапептида получены три аминокислоты: глицин, аланин и лизин в мольном соотношении 3: 1: 1. При частичном гидролизе того же пентапептида было выделено три разных трипептида и три разных дипептида (наряду с отдельными аминокислотами). Определение N-концевых аминокислот в этих трипептидах показало, что в двух их них N-концевой аминокислотой является глицин, а в третьем – аланин. Определите последовательность аминокислот (первичную структуру) в молекуле пентапептида и напишите его структурную формулу.
22. УГЛЕВОДЫ. НУКЛЕИНОВЫЕ КИСЛОТЫ
1. Приведите примеры перечисленных ниже сахаров. Напишите их структурные формулы и названия. Не используйте один и тот же пример дважды.
а) альдоза; б) кетоза; в) альдогексоза;
г) альдопентоза; д) кетогексоза; е) моносахарид;
ж) триоза; з) аминосахар; и) дезоксисахар.
2. Напишите все таутомерные формы для: а) L-фруктозы; б) 2-дезокси-D-галактозы; в) L-сорбозы.
3. Приведите факты, доказывающие существование сахаров в растворах в виде циклических структур.
4. Напишите формулы Хеуорса для каждого из приведенных ниже дисахаридов:
а) 6-О-β -D-глюкопиранозил-β -D-глюкопиранозы,
б) 4-О-β -D-галактопиранозил-α -D-глюкопиранозы,
в) 4-О-β -D-ксилопиранозил-L-арабинозы,
г) 6-O-α -D-галактопиранозил-D-фруктозы.
5. Чем объяснить, что дисахарид лактоза может существовать в двух аномерных формах, а у другого дисахарида - сахарозы - аномерных форм не обнаружено?
6. Хотя D-глюкозу относят к D-ряду из-за конфигурации при С-5, обращение конфигурации при С-5 не делает ее L-глюкозой. Почему? Что произойдет при таком обращении конфигурации?
7. Есть ли среди перечисленных ниже сахаров энантиомеры?
а) α -D-глюкопираноза и β -D-глюкопираноза,
б) α -L-глюкопираноза и β -L-глюкопираноза,
в) α -L-глюкопираноза и β -D-глюкопираноза,
г) α -D-глюкопираноза и α -L-глюкопираноза,
д) α -L-фруктофураноза и β -L-фруктофураноза.
8. Удельное вращение α -D-маннозы +29.3º, а β -аномера –17.0º. В воде соединения претерпевают мутаротацию, давая раствор с удельным вращением +14.2º. Рассчитайте относительные количества α - и β -аномеров, между которыми установилось равновесие.
9. D-идоза и D-талоза различаются по конфигурации только при одном атоме углерода, но они не способны к взаимопревращению при растворении в воде, хотя и обнаруживают мутаротацию. Объясните это явление.
10. Назовите продукт (или продукты) реакции D-глюкозы с каждым из перечисленных ниже соединений:
а) бромная вода и карбонат стронция;
б) фенилгидразин, взятый в избытке;
в) азотная кислота;
г) уксусный ангидрид;
д) боргидрид натрия;
е) иодная кислота (HIO4);
ж) иодистый водород и фосфор;
з) гидроксиламин (NH2OH);
и) диметилсульфат и водный раствор основания;
к) этанол и хлористый водород;
л) бензоилхлорид и пиридин;
м) метанол и хлористый водород, затем иодная кислота;
н) бромная вода, затем карбонат кальция, после чего пероксид водорода в присутствии Fe3+.
11. В природных условиях L-аскорбиновая кислота образуется из D-глюкозы. Эта кислота более сильная (её рКа=4.2), чем уксусная (рКа=4.7). Объясните кислотность аскорбиновой кислоты и напишите реакцию ее нейтрализации.
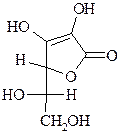
L-аскорбиновая кислота
12. D-Фруктоза даёт реакцию серебряного зеркала с аммиакатом серебра, хотя в ней альдегидной группы нет. Это объясняется енолизацией кетозы под действием основания, приводящей к ендиолу, и последующими равновесными превращениями. Что это за превращения? Какие соединения в действительности реагируют с аммиачным раствором оксида серебра?
13. В природе имеется огромное множество гликозидов. Напишите структурную формулу арбутина (4-гидроксифенил-β, D-глюкопиранозида). Он содержится в листьях некоторых деревьев (например, груши), которые осенью становятся не жёлтыми или красными, а черными. Это происходит вследствие ферментативного расщепления арбутина на D-глюкозу и гидрохинон (напишите схему превращения). Последний при окислении на воздухе даёт черную окраску. Прометилируйте арбутин.
14. Амигдалин - гликозид, в котором дисахарид генциобиоза связан с остатком нитрила D-(-)-миндальной кислоты. Выделен из семян горького миндаля Prunus amygdalis. Установлено, что амигдалин расщепляется эмульсином миндаля на D-глюкозу, бензальдегид и цианистый водород. Напишите уравнение реакции.

15. Трисахарид D-раффиноза не реагирует с раствором Фелинга и аммиачным раствором оксида серебра. При гидролизе D-раффинозы образуются D-глюкоза, D-галактоза и D-фруктоза, а при гидролизе полностью метилированной раффинозы – 2, 3, 4-три-О-метилглюкоза, 1, 3, 4, 6-тетра-О-метилфруктоза и 2, 3, 4, 6-тетра-О-метилгалактоза. На основании этих данных напишите возможные формулы раффинозы. Какая дополнительная информация необходима для того, чтобы сделать выбор между этими структурами?
16. При гидролизе дисахарида мелибиозы образуется смесь D-глюкозы и D-галактозы. С реактивом Толленса мелибиоза дает реакцию ''серебряного зеркала''. Бром окисляет мелибиозу до мелибионовой кислоты. В результате метилирования мелибионовая кислота превращается в окта-О-метилмелибионовую кислоту. Гидролиз окта-О-метилмелибионовой кислоты дает тетра-О-метилглюконовую кислоту (А) и тетра-О-метилгалактозу (Б). Под действием азотной кислоты соединение (А) окисляется до тетра-О-метилглюкаровой кислоты. Соединение (Б) получают при помощи кислотного гидролиза 1-этил-2, 3, 4, 6-тетра-О-метилгалактопиранозида. Гидролиз мелибиозы катализирует фермент α -галактозидаза. На основании этих данных напишите структурную формулу мелибиозы.
17. Напишите таутомерные превращения урацила, тимина, гуанина, цитозина. Какой из таутомеров в каждом случае преобладает в водном растворе данного соединения?
18. Напишите структурные формулы нуклеотидов: 5'-дезоксиадениловой кислоты, 5'-уридиловой кислоты, гуанозин-5'-монофосфата, цитидинмонофосфата. Укажите N-гликозидную и сложноэфирную связи.
19. Приведите полную структурную формулу антикодона для кодона GCA.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Грандберг И.И. Практические работы и семинарские занятия по органической химии / И.И. Грандберг. - М.: Дрофа, 2001. – 347 с.
2. Веселовская Т.К., Мачинская И.В., Пржиялговская Н.М. Вопросы и задачи по органической химии / Т.К. Веселовская, И.В. Мачинская, Н.М. Пржиялговская. - М.: Высшая школа, 1977.
3. Кост А.Н., Сагитуллин Р.С., Терентьев А.П. Упражнения и задачи по органической химии / А.Н. Кост, Р.С. Сагитуллин, А.П. Терентьев. - М.: Высшая школа, 1974. - 222 с.
4. Сборник задач по органической химии: учебное пособие / Под ред. А.Е. Агрономова / М.: МГУ, 2000. – 160 с.
5. Методические указания к выполнению курсовой работы по органической химии / Сост. М.Н. Земцова. – Самара: СамГТУ, 2005. – 23 с.
6. Курц А.Л., Ливанцов М.В., Чепраков А.В. и др. Задачи по органической химии с решениями / А.Л. Курц, М.В. Ливанцов, А.В. Чепраков и др. - М.: БИНОМ. Лаборатория знаний, 2004. – 264 с.
7. Названова Г.Ф. Вопросы и задачи по органической химии для студентов-химиков. Ч. 1 / Г.Ф. Названова. - Самара: Изд-во Самарского университета, 1997. – 38 с.
8. Названова Г.Ф. Вопросы и задачи по органической химии для студентов-химиков. Ч. 2 / Г.Ф. Названова. - Самара: Изд-во Самарского университета, 1997.
9. Дерябина Г.И. Задачи и упражнения по органической химии / Г.И. Дерябина. – Куйбышев: Куйбышевский госуниверситет, 1989. – 32 с.
10. Сборник задач и упражнений по биоорганической химии / Сост. Зык Н.В., Белоглазкина Е.К., Подругина Т.А., Сосонюк С.Е. – Москва: Химический факультет МГУ, 2002. – 31 с.
ОГЛАВЛЕНИЕ
Введение. 3
1. Типы химической связи, её характеристики и свойства. 4
2. Структуры Льюиса. Классификация реагентов и реакций. Стабильность промежуточных частиц. 7
3. Алканы.. 11
4. Алкены.. 15
5. Диеновые углеводороды (алкадиены) 19
6. Алкины.. 22
7. Алициклические соединения. 25
8. Углеводороды ряда бензола. 28
9. Многоядерные ароматические соединения. 33
10. Галогенопроизводные углеводородов. 36
11. Предельные одноатомные спирты.. 42
12. Фенолы и ароматические спирты.. 46
13. Альдегиды и кетоны жирного ряда. 49
14. Ароматические альдегиды и кетоны.. 52
15. Карбоновые кислоты и их производные. 59
16. Многоосновные и замещенные карбоновые кислоты, их производные. 63
17. Нитросоединения. 67
18. Амины.. 70
19. Диазо- и азосоединения. Азокрасители. 74
20. Гетероциклические соединения. 78
21. Аминокислоты. Белки. 83
22. Углеводы. Нуклеиновые кислоты.. 86
Библиографический список. 90
Учебное издание
Составители: ЗЕМЦОВА Маргарита Николаевна
ОСЯНИН Виталий Александрович
КЛИМОЧКИН Юрий Николаевич
|
|