
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
УДК 547 1 страница
|
|
М.Н. ЗЕМЦОВА
В.А. ОСЯНИН
Ю.Н. КЛИМОЧКИН
ОРГАНИЧЕСКАЯ ХИМИЯ
Сборник задач и упражнений
Самара
Самарский государственный технический университет

| Федеральное агентство по образованию ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» |
К а ф е д р а «Органическая химия»
М.Н. ЗЕМЦОВА
В.А. ОСЯНИН
Ю.Н. КЛИМОЧКИН
ОРГАНИЧЕСКАЯ ХИМИЯ
Сборник задач и упражнений
Самара
Самарский государственный технический университет
Печатается по решению редакционно-издательского совета СамГТУ
УДК 547
Органическая химия: сборник задач и упражнений / Сост. М.Н. Земцова, В.А. Осянин, Ю.Н. Климочкин. – Самара: Самар. гос. техн. ун-т, 2010. - 91 с.
В сборнике приводятся задачи и упражнения по изомерии, номенклатуре, способам получения и химическим свойствам органических соединений различных классов.
Сборник предназначен для студентов, обучающихся по специальности 020101 «Химия», а также для студентов, занимающихся углубленным изучением органической химии.
УДК 547
Рецензенты: д-р хим. наук Н.В. Макарова,
д-р фарм. наук В.А. Смирнов
Ó М.Н. Земцова, В.А. Осянин,
Ю.Н. Климочкин, составление, 2010
Ó Самарский государственный
технический университет, 2010
ВВЕДЕНИЕ
Основой для глубокого усвоения теоретического материала по органической химии является решение задач по разным разделам курса. Решение задач способствует расширению представлений о влиянии природы химической связи, пространственного и электронного строения органических молекул на их свойства. Это развивает самостоятельность, активизирует творческую работу студентов и, кроме того, позволяет осознанно и быстро усвоить значительный объем информации по органической химии.
В настоящее время развиваются новые педагогические технологии преподавания естественных наук, в основу которых положен принцип индивидуализации обучения, самостоятельного «добывания знаний».
Сборник содержит задачи и упражнения по основным классам органических соединений в объеме, достаточном для выдачи комплекта индивидуальных заданий каждому студенту. При их составлении использованы основные положения теоретической и синтетической органической химии.
Содержание настоящего издания соответствует типовой программе курса органической химии для химических специальностей университетов.
Сборник предназначен для практических занятий, подготовки к контрольным работам, коллоквиумам, экзаменам и выполнения курсовых аналитических задач. Надеемся, что данный сборник задач будет полезен и интересен для студентов химико-технологических специальностей, углубленно изучающих органическую химию.
1. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ,
ЕЁ ХАРАКТЕРИСТИКИ И СВОЙСТВА
1. Что является предметом изучения органической химии? Чем обусловлено выделение органической химии в самостоятельную научную дисциплину? Укажите причины многообразия органических соединений.
2. К какому классу следует отнести следующие соединения:
а) бутан; б) ацетон СН3—СО—СН3; в) хлороформ СНСl3;
г) анилин; д) тиофен; е) тетрагидрофуран; ж) циклобутан?
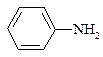
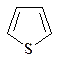
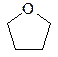
3. Напишите все возможные структурные формулы изомеров, отвечающих приведенным ниже брутто-формулам: a) C4H9Cl; б) С3Н8О; в) С5Н10.
4. Укажите соединения, для которых возможна стереоизомерия, и напишите формулы соответствующих стереоизомеров.
а) СН3СН(ОН)СН2СН3; б) Н2С=С(СН3)СН=СН2;
в) H2N–CH2–COOH; г) Н3ССН=СНСН3;
д) 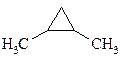 ; е)
; е) 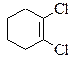
5. Какие виды гибридизации возможны для атома углерода в органических молекулах? Объясните в каждом случае, какова форма и пространственная направленность атомных орбиталей. Определите гибридизацию атомов С, N, Cl, O в следующем соединении:
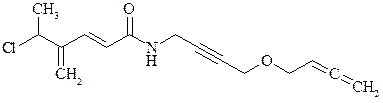
6. Укажите частицы, все атомы которых лежат в одной плоскости.
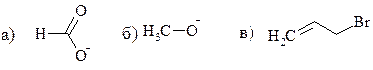

7. Дайте определение σ - и π -связям. Укажите, какие из связей в нижеприведенных соединениях относятся к σ - или π -типу, а также типы орбиталей, участвующих в их образовании (в качестве иллюстрации это сделано для первого соединения).

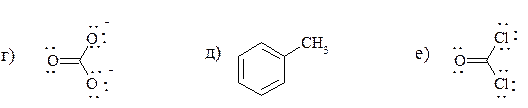
8. Нарисуйте атомно-орбитальные модели молекул:
а) метилазида 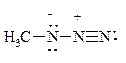 ; б) нитрометана H3C–NO2.
; б) нитрометана H3C–NO2.
Каково пространственное строение этих молекул? Какие АО участвуют в образовании связей в этих соединениях?
9. В каком случае донорно-акцепторное взаимодействие приводит к семиполярной связи? В чем ее отличие от ионной и ковалентной? Какие из приведенных соединений имеют семиполярную связь?
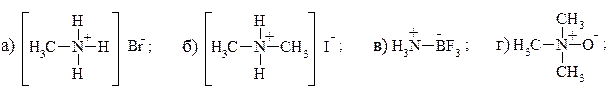
 .
.
10. Длина связи С=С составляет 0.134 нм, связи Н− Н – 0.06 нм; вычислите длину связи С− Н при втором углеродном атоме в соединении СН2=СН− СH3. Короче она или длиннее, чем одна из связей С− Н при атоме С3? Почему?
11. Какое соединение в каждой из перечисленных ниже пар имеет больший дипольный момент?
12. Укажите более высококипящее вещество в каждой паре:
а) СН3(СН2)3СН2ОН и СН3(СН2)3СН3;
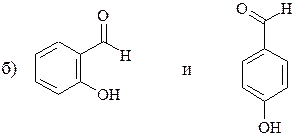 ;
;
в) H3С− СН2− СН=СН− Вr и Н3С− СН=СН− СН2− Вr.
13. Амины RNH2 (где R – углеводородные радикалы С1-С6) весьма летучи. Они определяют неприятный запах некоторых растений (борщевик обыкновенный, аронник пятнистый и др.), который привлекает к их соцветиям насекомых, питающихся падалью. Летучестью обладают также низшие карбоновые кислоты (например, муравьиная кислота HCOOH – летучий феромон тревоги муравьев). Чем можно объяснить причину отсутствия летучести у α -аминокислот:
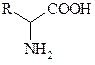 ?
?
2. СТРУКТУРЫ ЛЬЮИСА. КЛАССИФИКАЦИЯ
РЕАГЕНТОВ И РЕАКЦИЙ. СТАБИЛЬНОСТЬ
ПРОМЕЖУТОЧНЫХ ЧАСТИЦ
1. Напишите формулы Льюиса (электронные формулы) для приведенных соединений. Поставьте на всех атомах, не являющихся нейтральными, знаки зарядов.
а) СН3СООNа ацетат натрия;
б) CH3NO2 нитрометан;
в) CH3NHNa метиламид натрия;
г) НСООН муравьиная кислота;
д) CH3SO3H метансульфокислота;
е) НN3 азотистоводородная кислота;
ж) (CH3)2SO диметилсульфоксид.
2. Дополните атомы в указанных соединениях неподеленными электронными парами и поставьте, где необходимо, заряды:
a)CH3− NH2; б)[CH3− NH3]Cl; в) 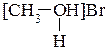 ; г) Н3С− ОН.
; г) Н3С− ОН.
Укажите, какие типы химической связи имеются в молекулах этих соединений.
3. Определите в приведенных структурах заряды.
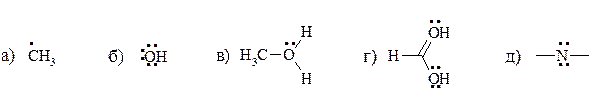
4. Каждая из следующих реакций представляет собой реакцию между кислотой Льюиса и основанием Льюиса. Укажите кислоту Льюиса и основание Льюиса среди исходных соединений в каждой реакции.

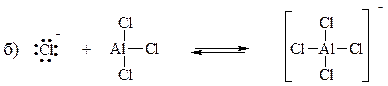

5. Каковы сопряженные кислоты следующих оснований?

6. Сравните основность следующих соединений:
а) СН3− СН2− СН2− NH2 и СН3− CH=CH− NH2;
б) Сl− СН2− СН2− NH2 и Br− СН2− СН2− NH2;
в) воды и аммиака; г) аммиака и амид-аниона;
д) ОН‾ и SH‾; е) анилина и циклогексиламина.
7. Расположите соединения в ряд по уменьшению рКа:
а) Н2О, С2Н5ОН, фенол (С6Н5–ОН) (ОН-кислоты);
б) этан, этилен, ацетилен (СН-кислоты);
в) метан, аммиак, вода, фтороводород.
Объясните причину наблюдаемой последовательности изменения кислотности.
8. В формулах приведенных соединений делокализация электронов показана изогнутыми стрелками:

Опишите строение этих соединений набором предельных (резонансных) структур.
9. Ниже представлены предельные структуры, описывающие строение метилформиата (а) и винилметилового эфира (б):
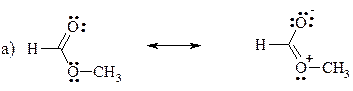
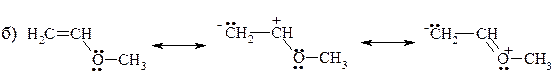
Опишите делокализацию электронов в указанных соединениях одной структурной формулой, дополненной изогнутыми стрелками.
10. Приведите граничные структуры для соединений:
а) HN3 азотистоводородная кислота; б) CH3CN ацетонитрил.
11. Укажите электронные эффекты, производимые гетероатомами в следующих соединениях:
а) СН3− СН2− О− СН3 б) Н2С=СН− О− СН3 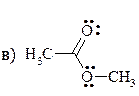
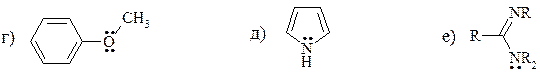
12. Расположите перечисленные ниже группы в порядке возрастания -М-эффекта:
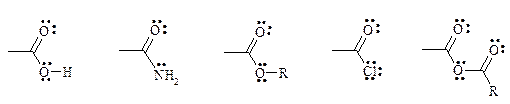
13. Расположите в ряд в порядке увеличения стабильности следующие радикалы:
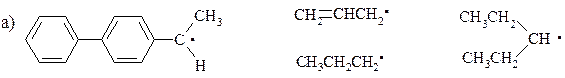
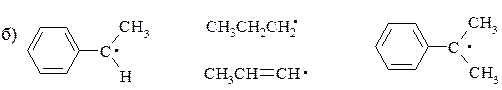
в) С•НCl2, C•H2Cl, C•H3
14. Расположите частицы в порядке увеличения стабильности:
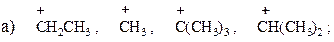

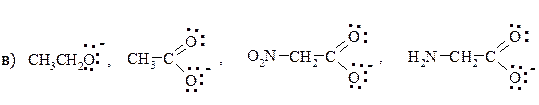
15. Дайте определения понятиям:
а) гетеролитический разрыв σ -связи;
б) гомолитический разрыв σ -связи;
в) электрофил;
г) нуклеофил;
д) реакция радикального замещения;
е) реакция электрофильного присоединения.
16. Какое из соединений будет легче вступать в реакции AdE типа (по С=С-связи) и почему?
а) СН3− СН=СН2; б) Н3С− О− СН=СН2; в) H2С=CH− CN.
17. Расположите перечисленные ниже реагенты в порядке возрастания их нуклеофильной активности в реакции с одним и тем же субстратом.
Реакция: RX +: Nu → R− Nu +: X
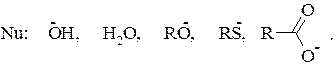
3. АЛКАНЫ
1. Учитывая имеющиеся закономерности, определяющие взаимосвязь физических свойств алканов с их строением, расположите углеводороды в порядке уменьшения их температур кипения:
а) 3, 3-диметилпентан; б) н -гептан; в) 2-метилгептан;
г) н -пентан; д) 2-метилгексан.
2. С помощью языка сжатых формул приведены углеводороды. Напишите эквивалентные им полные структурные формулы и назовите их по рациональной номенклатуре (а, б, г) и номенклатуре IUPAC.
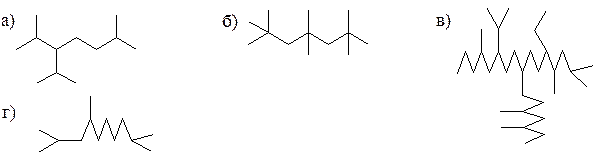
3. Назовите приведенные алкилы. Отметьте идентичные.
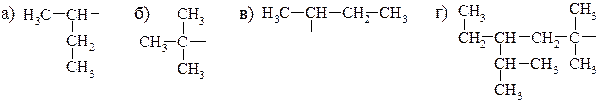
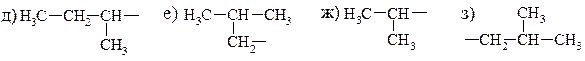
4. Напишите структурные формулы соединений, назовите их по систематической номенклатуре:
а) метилизобутилметан; б) метилди- трет -бутилметан;
в) изопропилизобутилметан.
5. Напишите структурную формулу наиболее богатого метильными группами углеводорода состава C8H18, получите его всеми возможными способами.
6. Алкан имеет плотность паров по воздуху 4.414. Определите брутто-формулу алкана.
7. Установите строение карбоновой кислоты, которая при сплавлении со щелочью образует изобутан, а электролиз водного раствора ее соли приводит к 2, 5-диметилгексану. Напишите схемы реакций.
8. Что понимают под термином " конформация молекулы"? Учитывая вращение только вокруг указанной чертой связи, приведите формулы Ньюмена для наиболее устойчивых конформеров:
а) (СН3)2СН− СН2СН3; б) (СН3)2СНСН2− СН2СН3.
9. Напишите реакцию монохлорирования 2-метилбутана. Опишите отдельные стадии свободнорадикального цепного процесса. Какие углеводородные радикалы образуются на лимитирующей стадии? Сравните их устойчивость. Какое направление реакции будет более вероятным?
10. Установите строение углеводорода С6Н14, при монобромировании которого образуется третичное бромпроизводное С6Н13Вr. Углеводород С6Н14 может быть получен по способу Вюрца и по Кольбе без побочных продуктов (привести реакции).
11. С помощью каких реакций можно осуществить переходы:
а) пропан → 2, 3-диметилбутан;
б) СН3− СН2− СООН → 2-нитробутан?
12. а) Фотохимическое окисление 2-метилпентана дает гидропероксид, образованию которого способствует присутствие инициатора - пероксида бензоила. Приведите структуру этого гидропероксида и механизм его образования.
б) Образовавшийся гидропероксид разлагается при нагревании, давая спирт и симметричный кетон (R2CO). Каковы структуры продуктов разложения?
13. Осуществите крекинг 2, 2-диметилпентана. Какие свободные радикалы могут при этом образоваться? Покажите, какие низкомолекулярные углеводороды (алканы и алкены) могут быть получены в результате последующих превращений радикалов.
14. Расположите приведенные ниже радикалы в порядке уменьшения их стабильности:
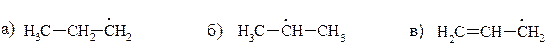
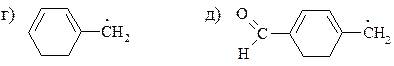
15. Используя в качестве источника дейтерия тяжелую воду, приведите схемы синтеза следующих соединений:
а) CD4, б) CH3D, в) СН3СD2CH3, г) СH3CH2CH2D.
16. Найдите формулу Ньюмена, соответствующую приведённой конформации молекулы 1-бромбутана:
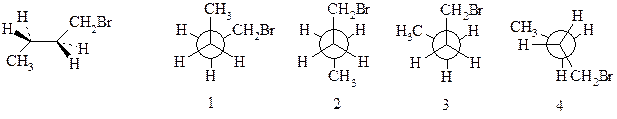
17. Назовите по рациональной номенклатуре «изооктан» (стандарт моторного топлива с октановым числом 100).
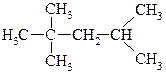
Укажите число первичных, вторичных, третичных и четвертичных атомов углерода. Сколько различных монохлорпроизводных можно получить из «изооктана»? Укажите положение заместителя в наиболее вероятном продукте радикального замещения: а) с учётом лишь стабильности промежуточного радикала; б) с учётом лишь статистического фактора.
18. Триптан (2, 2, 3-триметилбутан) – алкан с наивысшим октановым числом 130. Рассчитайте состав (в %) монохлорпроизводных в смеси, полученной при термическом хлорировании триптана, если отношение скоростей реакции замещения водорода у первичного, вторичного и третичного атома углерода составляет 1: 3.3: 4.4. Как изменится состав монозамещённых триптана при бромировании, если соотношение реакционных способностей связи С− Н у первичного, вторичного и третичного атомов углерода составляет 1: 32: 1600?
19. Напишите схемы распада гидропероксидов следующего строения:
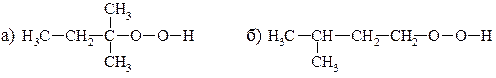
20. С какими из приведённых ниже соединений реагирует н -бутан при заданных условиях? Напишите эти реакции. Для реакций, отмеченных звёздочками, приведите механизмы: а) Н2SO4 (конц.), 20º С; б) HNO3 (конц.), 20º С; в) Nа, 20º С; г) Br2, в темноте, 20º С; д*) Br2, освещение, 20º С; е) КМnО4, Н2О, 20º С; ж*) НNО3 (разб.), 140º С, давление; з) О2, пламя; и) НВr; к) SO2 + Cl2, освещение, 20º С; л) I2, освещение, 20º С; м) CoF3 (изб.).
21. При хлорировании эквимолярной смеси этана и неопентана (тетраметилметана) этилхлорид и неопентилхлорид образуются в соотношении 1: 2.3. Определите относительные скорости реакций замещения атомов водорода в этих соединениях.
22. Назовите алканы, являющиеся продуктами следующих реакций:
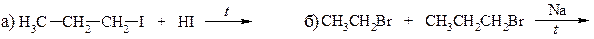

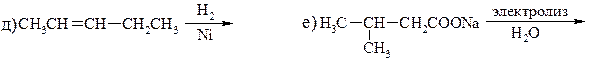
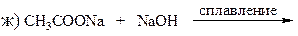
23. Какое строение имеет углеводород С10Н22, если известно, что он был получен электролизом водного раствора соли карбоновой кислоты, которая при сплавлении со щёлочью образует тетраметилметан?
24. Установите строение алкилиодида, который при нагревании с НI дает изобутан, а с Na образует 2, 5-диметилгексан. Приведите схемы реакций.
4. АЛКЕНЫ
1. Назовите приведенные ниже соединения и радикалы по номенклатуре IUРАС.
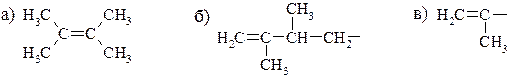
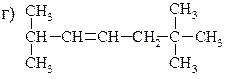
2. Назовите алкены и обозначьте их конфигурации по Е, Z-системе.

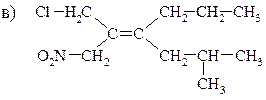
3. Напишите формулы Е- и Z-изомеров 1-хлор-2-бромбутена-1, 1-хлор-1-бромбутена-1 и 3, 6-диметил-4- трет -бутилгептена-3.
4. Представьте схемы синтеза следующих соединений:
а) пропилена из метилацетилена;
б) пентена-2 из 2-бромпентана, из пентанола-1, из 2, 2-дибромпентана;
в) 2-метилгексена-2 из спирта, из алкилгалогенидов.
5. Предложите наиболее целесообразные пути синтеза 2, 4-диметилпентена-1 и 2, 4-диметилпентена-2 из одного и того же исходного соединения - 2, 4-диметил-2-хлорпентана. Представьте переходные состояния, предшествующие образованию данных алкенов.
6. Нарисуйте атомно-орбитальную модель диимина N2H2. Какова гибридизация атома азота в этом соединении? Было показано, что из двух возможных изомеров диимина только один способен восстанавливать алкены. Объясните причину этого явления.
7. Какие частицы называются карбокатионами? Расположите следующие карбокатионы в порядке возрастания их устойчивости:

8. Гидратация соединения А в присутствии кислоты приводит к продуктам Б и В, но не Г.
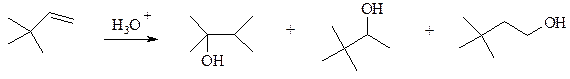
А Б В Г
Объясните, почему это происходит.
9. Как химическим путем можно разделить смесь н -пентана и пентена-1?
10. Установите строение мономера, если известно, что его димер в результате озонолиза образует смесь ацетона и триметилуксусного альдегида.
11. Напишите структурную формулу соединения состава С6Н12, если известно, что оно обесцвечивает бромную воду, при гидратации образует третичный спирт состава С6Н13ОН (т.е. ОН-группа находится при третичном атоме углерода), а при окислении хромовой смесью - ацетон и пропионовую кислоту (СН3СН2СООН). Напишите уравнения реакций.
12. Напишите уравнения всех последовательных реакций:
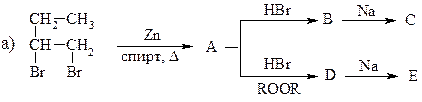



13. Какие продукты образуются при взаимодействии α, α -диметилэтилена с: 1) хлором; 2) хлором в СН3ОН; 3) НВr в темноте; 4) HBr + ROOR; 5) KMnO4 в нейтральной среде при низкой температуре; 6) KMnO4 в кислой среде при повышенной температуре; 7) дибораном с последующей обработкой уксусной кислотой.
14. Расположите в порядке увеличения скорости взаимодействия с НВr следующие соединения (ответ аргументируйте):
а) этилен, пропилен, трифторметилэтилен, винилхлорид;
б) 1-хлорбутен-1, бутен-1, бутен-2, 1-хлорбутен-2.
15. Из пропилена получите 1-бромпропан, 2-бромпропан, 3-бромпропен.
16. При выдерживании тетраметилэтилена с каталитическим количеством Н3РО4 образуется смесь 2, 3-диметилбутена-1 (31%), 3, 3-диметилбутена-1 (3%) и исходного 2, 3-диметилбутена-2 (61%). Объясните данный факт.
17. Какие реагенты надо использовать для получения 3, 4-диметилгексена-3 из следующих веществ:
а) 3, 4-диметил-3, 4-дихлоргексан; б) 3-бром-3, 4-диметилгексан;
в) метилэтил- втор- бутилкарбинол СН3С(ОН)(С2Н5)СН(СН3)С2Н5?
18. Для 1-пентена и для цис- и транс -2-пентенов были найдены следующие теплоты сгорания: 3367.6, 3378.4 и 3371.7 кДж/моль. Какая величина соответствует каждому изомеру?
19. Предскажите главные продукты реакций:
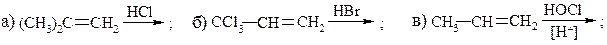

20. Объясните результаты приведённых реакций:
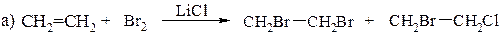 *
*
б) (СН3)3С− СН=СН2 + НСl → (СН3)3ССНClСН3 + (СН3)2СCl− СН(СН3)2
в) (СН3)2С=СН2 + СH2=СН2 + НСl → ClCН2CН2− С(СН3)3
21. Приведите механизмы следующих реакций:
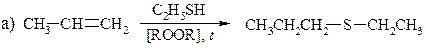

22. Напишите полные уравнения восстановления 1-бутена в указанных условиях: а) Н2 [Pt]; б) Н2 [Ni Ренея]; в) Н2N− NH2 [H2O2, CuCl2]; г) В2Н6, затем СН3СООН; д) Н2 [RhCl3+(C6H5)3P, бензол]. Дайте определение таким понятиям, как гетерогенное и гомогенное каталитическое гидрирование.
23. Приведите полные уравнения реакций окисления 2-пентена в следующих условиях: а) C6H5CO3H [CH2Cl2, 25º C]; б) KMnO4 [H2O, 0º C]; в) ОsO4, затем NaHSO3 [Н2О]; г) О3, затем Zn в CH3COOH; д) KMnO4 [H2SO4, t º ]; е) K2Cr2O7 [H2SO4, t º ].
24. Напишите уравнения реакций и назовите образующиеся алкены.

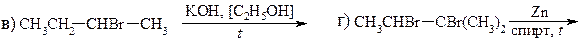

25. Заполните схемы превращений:

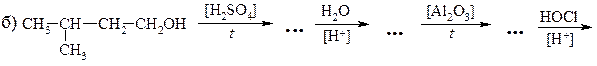
26. Используя в качестве исходного соединения 1-бутен, получите:
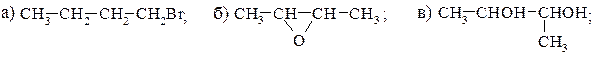
г) СН3− СН2− СНОН− СН2Сl; д) СН3− СН=СН− СН2Сl; е) СН3− СН2− СНО.
5. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ)
1. Напишите структурные формулы изомерных диеновых углеводородов состава C5H8. Назовите их по IUPAC-номенклатуре. К какому типу диенов относится каждый из них?
2. Нарисуйте формулы следующих геометрических изомеров:
а) Е, Е-октадиена-3, 5 (для S- цис -конформации);
б) Е, Z-октадиена-3, 5 (для S- транс -конформации).
3. Назовите по международной номенклатуре:
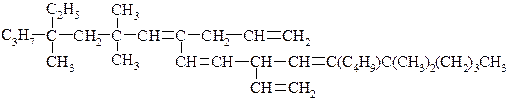
4. Получите диеновые углеводороды из следующих соединений:
а) 1, 3-дихлор-2-метилбутана; б) 2, 3-дибромбутена-1.
5. Ниже приведен порядок связи (число ковалентных связей между атомами углерода) для этана, этилена, ацетилена и дивинила:

Почему для дивинила эти величины являются дробными?
6. Объясните, почему теплота гидрирования пентадиена-1, 4 (254.56 кДж/моль) вдвое больше теплоты гидрирования бутена-1, а у бутадиена-1, 3 она составляет лишь 239 кДж/моль.
7. Почему протонирование по атомам углерода С2 и С3 2-метилбутадиена-1, 3 можно расценивать как несущественное?
|
|