
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Т а б л и ц а 5.2
|
|
| № пробы | Текущее время отбора пробы (по часам) | Время от начала реакции τ, мин | Объем раствора Na2S2O3, пошедшего на титрование пробы, см3 | Убыль концентрации ацетона cх, моль/дм3 | Константа скорости реакции k |
Обработка опытных данных
1. Построить график зависимости Vt = f (t).
2. Рассчитать изменение концентрации ацетона по уравнению
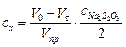 ,
,
где Vt – объем раствора Na2S2O3, израсходованного на титрование пробы, взятой через t мин от начала реакции, см3; Vпр – объем пробы, см3;  – концентрация раствора Na2S2O3, моль/дм3.
– концентрация раствора Na2S2O3, моль/дм3.
Значение V0 определить из графика экстраполяцией зависимости до t = 0.
3. Рассчитать начальные концентрации ацетона 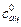 и кислоты
и кислоты 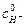 в реакционной смеси по формуле
в реакционной смеси по формуле
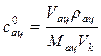 ,
,
где Vац – объем ацетона, см3; rац – плотность ацетона, кг/м3;
Mац – молярная масса ацетона, кг/кмоль.
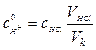 ,
,
где cHCl – концентрация соляной кислоты, моль/дм3; VHCl – объем кислоты, см3; Vk – объем реакционной смеси (мерной колбы), см3.
4. Рассчитать по уравнению (5.19) константу скорости с использованием данных табл. 5.2 для каждой экспериментальной точки. Найти среднее значение константы скорости, записать ее размерность.
5. Вычислить энергию активации по уравнению (5.13), используя константы скорости при двух температурах.
6. Рассчитать по уравнению (5.19) время, за которое конверсия ацетона составит 10, 90, 99 %.
Контрольные вопросы и задания
1. Основной закон химической кинетики: скорость, константа скорости, порядок, молекулярность реакции.
2. В чем сущность химической кинетики? Что означает термин " кинетика"?
3. Уравнения скорости химической реакции первого, второго, n-го порядков.
4. Описать механизм реакции йодирования ацетона. По какому веществу ведется наблюдение за скоростью реакции иодирования?
5. Преобразовать общий вид уравнения скорости химической реакции второго порядка и его решение, учитывая особенности механизма реакции иодирования.
6. Способы определения порядка реакции.
7. Что такое период полупревращения, и как он связан с константой скорости для реакции первого и второго порядка?
8. Влияние температуры на скорость реакции. Уравнение Аррениуса.
Лабораторная работа № 20
|
|