
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Исследование кинетики растворения малорастворимых соединений
|
|
Цель работы: определение константы скорости растворения малорастворимого соединения при заданных температурах и скорости перемешивания и энергии активации процесса растворения.
Реактивы: навеска малорастворимого соединения (CaSO4, CaCO3, Ca(OH)2 и др.), дистиллированная вода.
Теоретические сведения
Процесс растворения твердых веществ в жидких растворителях состоит из двух стадий. Первая стадия представляет собой переход молекул или ионов из твердой фазы в жидкий раствор и связь с молекулами растворителя (сольватация). Часть этих частиц будет возвращаться к поверхности кристалла. Скорость обратной реакции процесса возвращения частиц в кристаллическую решетку прямо пропорциональна их концентрации в растворе и растет по мере накопления его в растворе. Когда скорости обоих процессов (растворения и кристаллизации) станут равными и концентрация вещества в растворе перестанет изменяться, раствор станет насыщенным и установится равновесие между двумя фазами.
Одновременно, в результате диффузии, растворимое вещество распространяется от поверхности кристалла в глубь раствора. Скорость этого процесса значительно медленнее, поэтому процесс растворения определяется скоростью диффузии.
При перемешивании жидкости некоторый слой d, прилегающий к поверхности твердого тела, остается в относительном покое. Количество вещества, переходящего в раствор в единицу времени

где с – концентрация вещества в растворе;
V – объем раствора, определяется законом Фика;
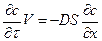 (5.27)
(5.27)
где 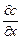 – градиент концентрации в нормальном к поверхности кристалла направлении; S – площадь диффузии; D – коэффициент диффузии.
– градиент концентрации в нормальном к поверхности кристалла направлении; S – площадь диффузии; D – коэффициент диффузии.
Согласно закона Фика концентрация у поверхности кристалла меняется линейно от снас при х = 0 до с при х = d, поэтому (5.27)можно преобразовать к следующему виду:
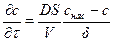
или 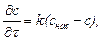 (5.28)
(5.28)
где k – константа скорости растворения; k = DS/ (Vd);
Интегрированием (5.28) легко получить формулу для расчета константы скорости растворения
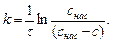 (5.29)
(5.29)
В разбавленных растворах CaSO4, CaCO3, Ca(OH)2 и др. можно принять, что подвижности ионов не зависят от концентрации раствора и удельная электрическая проводимость æ в первом приближении пропорциональна концентрации с. В этом случае выражение (5.29) можно преобразовать к виду:
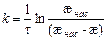 ,
,
где æ нас – удельная электрическая проводимость насыщенного раствора.
Описание экспериментальной установки
|

Рис. 5.2. Схема установки:
1 – ячейка; 2 – электроды;
3 – термостатирующий стакан;
4 – мешалка; 5 – кондуктометр
Порядок выполнения работы
Ячейку 1 (рис. 5.2) заполнить дистиллированной водой и термостатировать при заданной температуре 10-15 мин. Затем внести исследуемое вещество и через определенные промежутки времени (по указанию преподавателя) фиксировать электрическую проводимость L. Измерения осуществлять до постоянного значения Lнас, что соответствует насыщению раствора. Полученные результаты внести в табл. 5.7.
Т а б л и ц а 5.7
| № измерения | Текущее время | Время от начала реакции t, мин | L, См | k | T, K |
Обработка опытных данных
1. Поскольку æ пропорциональна L, константу скорости растворения малорастворимого соединения для каждого
измерения рассчитать по уравнению
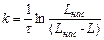 .
.
Вычислить среднюю константу скорости.
2. Энергию активации найти по уравнению (5.13). Одна из констант в уравнении (5.13) определена, а другая должна быть взята из опыта, поставленного при иной температуре.
Контрольные вопросы и задания
1. Проанализировать кинетические уравнения изменения концентрации реагирующих веществ для реакций первого и второго порядков.
2. Зависит ли и как от исходных концентраций реагирующих веществ период полупревращения для реакций первого и второго порядка?
3. Как влияет температура на скорость химических реакций?
4. Рассмотреть зависимость скорости химических реакций от температуры. Пояснить смысл величин, определяющих эту зависимость.
5. Какие вы знаете методы расчета энергии активации?
|
|