
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Приклад розв’язання задачі
|
|
До п 1 :. Енергію активації реакції знаходимо за інтегральною формулою, яка походить з рівняння Ареніуса: 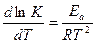 ,
,
 (24)
(24)

До п.2: Передекспоненційний множник можна розрахувати за експоненційною формою рівняння Ареніуса:
 (25)
(25)
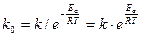 (26)
(26)
Обчислюємо k0 при двох температурах (значення повинні бути близькими) і знаходимо середнє значення:
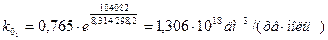
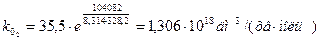
Тобто: k0 = 1, 306 × 1018 дм3/(хв× моль)
До п.3: Для обчислення константи швидкості даної реакції за Т3 також використаємо інтегральну форму рівняння Арреніуса (24):
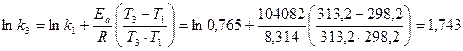

До п.4: Дана реакція (вар.25) є реакцією 1-го порядку. Тому кількість вихідної речовини, що прореагувала за час t, обчислюємо за формулою:
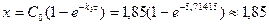 моль/дм3.
моль/дм3.
До п. 5: Температурний коефіцієнт швидкості реакції обчислюємо за правилом Вант-Гофа:
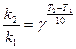 (27)
(27)
 ;
; 
До п. 6: Для того, щоб розрахувати, у скільки разів зросте швидкість реакції при підвищенні температури на 25 К, треба знайти відношення kT+25/kT за формулою Вант-Гофа(27), якщо правило виконується, або за інтегральною формулою Ареніуса (24).
Дана реакція підпорядковується правилу Вант-Гофа, тому:
kT+25/kT = γ 2, 5 = 3, 592, 5 = 24, 48 разів.
|
|