
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Выполнение работы. 1. Налейте из бюретки в три пронумерованные пробирки раствор серной кислоты с концентрацией [H2SO4] = 0,2 моль/л в количестве ai мл (согласно варианту
|
|
1. Налейте из бюретки в три пронумерованные пробирки раствор серной кислоты с концентрацией [H2SO4] = 0, 2 моль/л в количестве ai мл (согласно варианту работы).
2. Налейте из бюретки в три пронумерованные колбы раствор тиосульфата натрия с концентрацией [Na2S2O3] = 0, 1моль/л в количестве бi мл, и в эти же колбы налейте дистиллированной воды в количестве вi мл (согласно варианту работы).
3. По очереди, выполняя каждый опыт, перелейте содержимое пробирки с раствором H2SO4 в соответствующую номеру опыта колбу с раствором Na2S2O3. Взболтайте полученный раствор, и по секундомеру замерьте время t от момента сливания до момента появления первых признаков помутнения раствора. При этом отсчет времени следует продолжать до одинаковой мутности раствора.
4. Рассчитайте концентрации исходных веществ, находящихся в реакционной смеси, пользуясь формулами
[H2SO4] = 0, 2 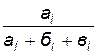 ;
;
[Na2S2O3] = 0, 1 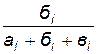 ,
,
где 0, 2 и 0, 1 моль/л - исходные концентрации H2SO4 и Na2S2O3;
ai, бi, вi – объем растворов (мл) H2SO4, Na2S2O3 и Н2О, взятых для опытов (индекс i означает номер опыта).
5. По полученным данным рассчитайте для каждого опыта значения ln  i, ln[H2SO4]i, ln[Na2S2O3]i. Данные опытов и вычислений запишите в табл. 7.
i, ln[H2SO4]i, ln[Na2S2O3]i. Данные опытов и вычислений запишите в табл. 7.
6. Постройте график зависимости ln  от ln[H2SO4], и по графику определите порядок реакции по серной кислоте n. Постройте график зависимости ln
от ln[H2SO4], и по графику определите порядок реакции по серной кислоте n. Постройте график зависимости ln  от ln[Na2S2O3], и по графику определите порядок реакции по тиосульфату натрия m. Так как величины логарифмов скорости и концентрации в данных опытах будут отрицательными, графики строятся в 3-м координатном угле. На оси ординат наносятся значения логарифма скорости. Экспериментальные точки должны находиться на прямой линии в пределах статистического разброса.
от ln[Na2S2O3], и по графику определите порядок реакции по тиосульфату натрия m. Так как величины логарифмов скорости и концентрации в данных опытах будут отрицательными, графики строятся в 3-м координатном угле. На оси ординат наносятся значения логарифма скорости. Экспериментальные точки должны находиться на прямой линии в пределах статистического разброса.
Таблица 7
| Данные опыта | Номер опыта | ||
| Количество H2SO4, (ai), мл | |||
| Количество Na2S2O3, (бi), мл | |||
| Количество Н2О (вi), мл | |||
| Концентрация серной кислоты [H2SO4] i | |||
| Концентрация тиосульфата натрия [Na2S2O3] i | |||
| ln [H2SO4] i | |||
| ln [Na2S2O3] i | |||
| Время реакции ti, с | |||
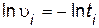
| |||
| Порядок реакции по серной кислоте n | |||
| Порядок реакции по тиосульфату натрия m | |||
| Константа скорости ki | |||
| Дифференциальное кинетическое уравнение |
7. Рассчитайте константу скорости для каждого опыта и найдите ее среднее значение.
8. Запишите дифференциальное кинетическое уравнение в явном виде, т.е. с числовыми значениями найденных порядков реакции и константы скорости.
Ответьте на следующие вопросы.
· Как зависит скорость химической реакции от концентрации реагирующих веществ?
· В чем отличие между общим порядком реакции и порядком реакции по данному веществу? Для чего определяют порядок реакции?
· В чем различие порядка и молекулярности реакции? Могут ли они быть равны?
· В чем физический смысл константы скорости реакции?
· От чего зависит константа скорости реакции?
Вопросы для самоконтроля
1. Что называют скоростью химической реакции? Какую размерность имеет скорость реакции? Дайте определение средней и истинной скорости.
2. Дайте определение простых и сложных реакций. Что такое молекулярность реакции? Что такое механизм химической реакции?
3. Как зависит скорость химической реакции от концентрации реагирующих веществ для элементарных реакций? Сформулируйте закон действующих масс.
4. Как зависит скорость химической реакции от концентрации реагирующих веществ для сложных реакций? Напишите дифференциальное кинетическое уравнение. Что называют порядком реакции? Как экспериментально определяют порядок реакции по данному веществу?
5. Как изменяются концентрации веществ во времени по мере прохождения реакции? Напишите интегральное кинетическое уравнение для реакции первого порядка.
6. От каких факторов зависит скорость химической реакции в гетерогенных системах?
7. Как и почему зависит скорость реакции от температуры? Напишите уравнение Аррениуса. Каков физический смысл констант уравнения? Какие экспериментальные данные необходимы для расчета энергии активации?
8. Объясните состояние химического равновесия с позиций химической термодинамики и химической кинетики. Дайте определения следующих понятий: обратимая химическая реакция; химическое равновесие; константа равновесия; равновесная концентрация вещества.
9. Как влияют изменения условий проведения химической реакции на состояние равновесия? Сформулируйте принцип Ле Шателье. Приведите примеры смещения химического равновесия.
10. Что называют катализатором? Какое влияние и почему оказывает катализатор на скорость химической реакции? Как влияет катализатор на состояние химического равновесия?
11. Дайте определение цепных реакций. Каков механизм цепных реакций?
Литература
1. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2006. Гл.10, п.10.5 – 10.7.
2. Коровин Н.В. Общая химия. – М.: Высш. шк., 2007. Гл. 6, п. 6.3.
Оглавление
| Введение…………………………………………………………………... 1. Основные понятия химической кинетики…………………............ | |
| 2. Скорость химических реакций………………………………………. | |
| 2.1. Гомогенные химические реакции…………………………….. | |
| 2.2. Зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ………..... | |
| 2.3. Графический метод определения констант дифференциального кинетического уравнения…………… | |
| 2.4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка. Интегральное кинетическое уравнение……………………………………….. | |
| 2.5. Скорость гетерогенной химической реакции………………... | |
| 2.6. Зависимость скорости химической реакции от температуры……………………………………………………… | |
| 2.6.1. Уравнение Аррениуса……………………………………. | |
| 2.6.2. Энергия активации……………………………………….. | |
| 2.6.3. Распределение молекул по энергиям……………….... | |
| 2.6.4. Энтропия активации. Стерический фактор…………... | |
| 2.6.5. Применение уравнения Аррениуса…………………… | |
| 3. Каталитические реакции……………………………………………... | |
| 3.1. Основные понятия……………………………………………….. | |
| 3.2. Сущность каталитического действия………………………… | |
| 3.3. Гомогенный катализ……………………………………………... | |
| 3.4. Гетерогенный катализ…………………………………………… | |
| 4. Химическое равновесие……………………………………………… | |
| 4.1. Состояние равновесия………………………………………….. | |
| 4.2. Константа равновесия…………………………………………... | |
| 4.3. Расчет равновесного состава продуктов химической реакции……………………………………………... | |
| 4.4. Смещение химического равновесия. Принцип Ле Шателье……………………………………………. | |
| 4.4.1. Изменение концентраций………………………………... | |
| 4.4.2. Изменение давления……………………………………... | |
| 4.4.3. Влияние температуры…………………………………… | |
| 5. Цепные реакции……………………………………………………….. | |
| 5.1. Неразветвленные цепные реакции…………………………… | |
| 5.2. Разветвленные цепные реакции………………………………. | |
| 6. Индивидуальные задания для самостоятельной подготовки студентов………………………………………………... | |
| 6.1. Примеры решения типовых задач……………………………... | |
| 6.2. Задачи для домашнего задания……………………………….. | |
| 6.3. Варианты домашних заданий…………………………………... | |
| 6.4. Варианты дополнительных домашних заданий……………. | |
| 7. Экспериментальная часть…………………………………………... | |
| Вопросы для самоконтроля…………………………………………….. | |
| Литература………………………………………………………………… |
Болячевская Клавдия Ильинична,
Литманович Андрей Аркадьевич,
Остаева Галина Юрьевна,
Панасенко Анатолий Александрович,
Полякова Елена Владимировна.
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ
Учебное пособие
Под общей редакцией проф. И.М. Паписова
|
|