
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние различных факторов на скорость реакции
|
|
Факторов, влияющих на скорость реакции, очень много. К ним относятся природа реагирующих веществ, их концентрация, давление, температура, наличие катализатора; для некоторых реакций – степень измельчения, наличие перемешивания, внешнее излучение, материал и форма реакционного сосуда и др.
Влияние природы реагирующих веществ. Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции, например, взрывы, протекают мгновенно, другие могут идти годами. Большую роль играет характер химических связей и строение молекул реагентов. Скорость реакции определяется скоростью разрыва одних и образования других химических связей. Величина энергии активации оказывается тем фактором, посредством которого сказывается влияние природы реагирующего вещества на скорость реакции.
Если энергия активации очень мала (меньше 40 кДж/моль), то значительная часть столкновений между частицами приводит к образованию продуктов. Скорость реакции в данном случае велика. Такими являются реакции между ионами в растворах электролитов, и протекают они практически мгновенно.
Напротив, если энергия активации реакции очень велика (больше 120 кДж/моль), то очень малая часть столкновений между реагирующими частицами приводит к образованию продуктов. Скорость такой реакции очень мала. Пример реакции – реакция синтеза аммиака:
3H2 + N2 = 2NH3.
Эта реакция при комнатной температуре практически не протекает.
Наконец, если энергия активации не очень мала и не очень велика (40–120 кДж/моль), то такая реакция будет протекать не очень быстро и не очень медленно, например:
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S.
Влияние концентрации реагентов. Порядок реакции. С увеличением концентраций, т.е. числа частиц в единице объема, возрастает число столкновений между частицами, в том числе и доля активных соударений. Следовательно, с увеличением концентраций реагентов возрастает скорость реакции.
Для элементарных, т.е. протекающих в одну стадию, реакций справедлив закон действия масс (К. М. Гульдберг, П. Вааге, 1867 г.): при постоянной температуре скорость элементарной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам, перед формулами веществ в уравнении реакции.
Для простой гомогенной реакции
aA +bB → продукты
ее скорость, согласно закону действия масс, выразится уравнением
v = k . C(A)a. C(B)b,
где v – скорость реакции; C(A) и C(B) – молярные концентрации реагирующих веществ А и В;
k– коэффициент пропорциональности, или константа скорости реакции .
Если C(A) = 1 и C(B) = 1, то v = k. Отсюда вытекает физический смысл константы скорости: константа скорости реакции – это скорость реакции, при которой молярные концентрации реагирующих веществ равны единице.
Константа скорости реакции не зависит от концентраций реагентов и тех факторов, которые меняют концентрацию (например, давление для газов), но зависит от всех других факторов, от которых зависит скорость реакции: природы реагирующих веществ, температуры, катализатора, площади поверхности раздела фаз (для гетерогенных реакций) и др.
Для обозначения молярной концентрации в химии часто применяют заключение формулы вещества в квадратные скобки, т.е. записи «С(А)» соответствует запись «[A]». Следовательно, для вышеприведенной реакции закон действия масс может быть записан в следующем виде:
v = k · [A]a· [B]b.
Для гетерогенной реакции, например горения угля,
С (Т) + О2(Г) = СО2 (Г)
закон действия масс запишется таким образом:
v = k′ · [C ·[O2] = k ·[O2],
поскольку k′ – постоянная величина и концентрация угля – постоянная величина (так как это твердое вещество), а произведение двух постоянных есть величина постоянная (k′ · [C] = k).
Следовательно, концентрации твердых веществ, так как это постоянные величины, не входят в закон действия масс для гетерогенных реакций.
Выражение зависимости скорости реакции от концентраций реагентов называют кинетическим уравнением скорости реакции. Для простых реакций и отдельных стадий сложных реакций закон действия масс и кинетическое уравнение скорости совпадают.
Для сложных реакций, т. е. протекающих в несколько стадий, закон действия масс неприменим. Если реакция сложная, например:
aA +bB → cC + dD,
то кинетическое уравнение скорости имеет вид:
v = k . [A]n(A). [B]n(B),
где n(A) и n(B) – величины, называемые порядком реакции по веществу А и В соответственно.
Сумма порядков реакций по всем веществам называется порядком реакции: n = n(A) + n(B).
Теоретически предсказать порядок реакции сложно, его определяют экспериментально. В общем случае порядок реакции по веществам не равен коэффициентам перед этими веществами в уравнении реакции: n(A) ≠ a, n(B) ≠ b. Порядок реакции по веществу, как и общий порядок реакции, может быть целым, дробным и нулевым (т.е не зависеть от концентрации). Вместе с тем, реакций, имеющих порядок реакции больше трех, не найдено.
Только для элементарных реакций порядок реакции по веществам совпадает с коэффициентами в уравнении, а общий порядок реакции – с молекулярностью.
Константа скорости реакции, входящая в закон действия масс для элементарных или в кинетическое уравнение скорости для сложных реакций, имеет определенные единицы измерения. Единицы измерения константы скорости зависят как от порядка реакции (или молекулярности), так и от типа реакции (гомогенная или гетерогенная) (в указаниях не приводятся).
Влияние температуры. При увеличении температуры энергия молекул возрастает. Увеличивается число столкновений, а также доля активных, т. е. ведущих к взаимодействию соударений - скорость реакции увеличивается (рисунок 5).
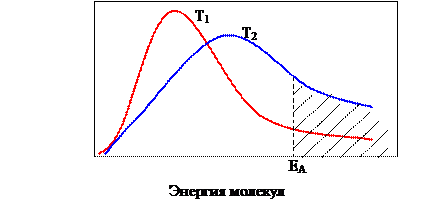
EА – энергия активных молекул.
Рисунок 5 – Распределение молекул по энергиям при двух температурах Т2> Т1
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза:
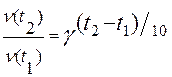 ,
,
где v(t2) и v(t1) – скорости реакции при температурах t2 и t1 соответственно;
γ – температурный коэффициент скорости данной реакции (или коэффициент Вант-Гоффа), показывающий, во сколько раз изменяется скорость реакции при изменении температуры на 10 градусов.
При изменении температуры меняется константа скорости: γ = kt+10 / kt.
Правило Вант-Гоффа соблюдается для ограниченного круга реакций, протекающих при температурах, близких к комнатным, и позволяет лишь примерно оценить влияние температуры на скорость реакции. Более точным является уравнение Аррениуса:
k = A ∙ e -Ea/RT ,
где A - постоянная, зависящая от природы реагирующих веществ;
е – основание натурального логарифма;
Ea – энергия активации;
R – универсальная газовая постоянная;
Т – абсолютная температура.
Из уравнения Аррениуса следует: даже небольшое снижение энергии активации приводит к значительному возрастанию скорости реакции; влияние температуры на скорость реакции тем сильнее, чем больше энергия активации реакции; реакции с высокими Еа при низких температурах протекают с малыми скоростями, однако влияние температуры на скорость таких реакций значительнее (  больше).
больше).
Катализ – явление изменения скорости химической реакции в присутствии веществ, называемых катализаторами. Катализаторы – вещества, не расходующиеся в ходе химической реакции, но влияющие на ее скорость. Каталитические реакции – реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) – убывает. Катализаторы, замедляющие химическую реакцию, называются ингибиторами. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты, примером отрицательного – снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Многие катализаторы обладают селективностью (избирательностью), то есть увеличивают выход определенных продуктов. Например, этанол в присутствии оксида алюминия при 350 º С разлагается па этилен и воду, а в присутствии меди при 250 º С – на уксусный альдегид и водород.
Каталитическая активность, т.е. способность ускорения реакции, многих положительных катализаторов возрастает при добавлении небольших количеств некоторых веществ, называемых промоторами (или активаторами), которые без катализатора могут быть каталитически неактивными. Например, скорость окисления SO2 на катализаторе V2O5 возрастает в сотни раз при добавлении сульфатов щелочных металлов. В то же время имеются вещества, которые ухудшают каталитическую активность. Их называют к аталитическими ядами. Так, следы мышьяка, фосфора вызывают быструю потерю катализатором V2O5 активности.
Механизм многих каталитических реакций очень сложен и не для всех полностью выяснен, однако некоторые закономерности являются общепризнанными. Так, катализаторы не влияют на термодинамику реакции, т.е. не изменяют энтальпию и энергию Гиббса реакции. Если энергия Гиббса реакции положительна, т. е. реакция невозможна, то катализатор не вызовет ее протекание; экзотермическая реакция останется экзотермической с тем же тепловым эффектом. Ускоряющее действие катализатора, как правило, заключается в уменьшении энергии активации процесса, так как каталитический процесс идет по другому пути, через другое переходное состояние, с образованием других промежуточных частиц. В присутствии катализатора образуются другие активированные комплексы с меньшей энергией активации, чем для некаталитической реакции (рисунок 6).
Различают два типа катализа: гомогенный - катализатор и реагирующие вещества находятся в одной фазе; гетерогенный – в разных фазах.
Примером гомогенного катализа является окисление SO2 до SO3 при нитрозном способе получения серной кислоты. Катализатор – оксид азота (II). Реакция протекает в две стадии:
1) c образованием промежуточного соединения 2NO + O2 = 2NO2;
2) с образованием конечного продукта и выходом катализатора из реакции 2NO2 + 2SO2 = 2SO3 + 2NO.
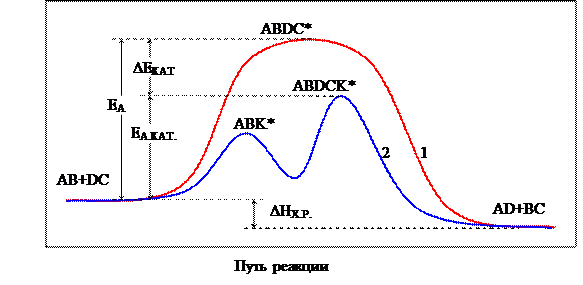
EА – энергия активации некаталитической реакции;
EА.КАТ. – энергия активации каталитической реакции;
DEКАТ – снижение энергии активации под влиянием катализатора;
ABDC* - активированный комплекс некаталитической реакции;
ABK* и ABDCK* - первый и второй активированные комплексы каталитической реакции;
DHХ.Р. – тепловой эффект реакции.
Рисунок 6 – Энергетическая диаграмма хода некаталитической (1) и каталитической (2) реакции AB+DC® AD+BC (K – катализатор).
Механизм гомогенного катализа объясняется теорией промежуточных соединений.
Примером гетерогенного катализа является окисление SO2 до SO3 при контактном способе получения серной кислоты. Катализатор – V2O5. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела - катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор часто наносят на твердый пористый носитель. Механизм гетерогенного катализа значительно сложнее и зависит от природы реакции. Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции. Переходные состояния представляют собой поверхностные соединения катализатора с реагирующими веществами. Имеется несколько теорий гетерогенного катализа.
Примерно три четверти всех химических производств используют катализаторы. Их применяют при получении аммиака, азотной и серной кислот, метанола, водорода, хлора, этилена, при крекинге углеводородов, получении маргарина и др. Катализ используют при решении экологических задач, например, очистке автомобильных выбросов, сточных вод.
Большую роль играет катализ в живой природе. Большинство химических реакций, протекающих в биологических системах, являются каталитическими. Катализаторы в этом случае называют ферментами. В организме человека находится около 30 000 различных ферментов; каждый из них служит эффективным катализатором соответствующей реакции.
|
|