
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Полнота сгорания топлива
|
|
Всякая химическая реакция обратима, т.е. она протекает и в прямом и в обратном направлениях. Так, например, для взаимодействующих друг с другом молекул А и В, из которых получаются вещества D и Е, уравнение реакции можно записать в виде:
maA + mbB  ↔ mdD + meE,
↔ mdD + meE,
где А и В - символы исходных веществ (субстратов реакции), D и Е - символы конечных продуктов реакции, ma, mb - число молей исходных продуктов, md, me - число молей конечных продуктов. Величины ma, mb, md и me - стехиометрические коэффициенты.
Всякая реакция горения сопровождается одновременным распадом продуктов сгорания на исходные вещества. Распад продуктов сгорания на исходные вещества или распад соединения на более простые вещества называется диссоциацией. Например, в реакции 2 СО + О 2↔ 2 СО 2 может происходить распад соединения продукта на более простые исходные вещества. Диссоциация наступает при определенных условиях, зависящих от температуры и давления.
Степенью диссоциации α называется доля моля вещества, разложившегося к моменту равновесия. Зависимость α от Т для двух реакций: 2 СО + О 2↔ 2 СО 2 и 2 Н 2+ О 2↔ 2 Н 2 О показана на рис. 2.2. Видно, что с точки зрения полноты сгорания весьма высокие температуры невыгодны из-за роста степени диссоциации.

Рис. 2.2. Зависимость степени диссоциации α от температуры
Реакция горения заканчивается тогда, когда в протекании химической реакции наступило равновесие, т.е. скорость прямой реакции стала равной скорости обратной реакции. Но из этого следует, что после прекращения горения в зоне реакции будут присутствовать как продукты сгорания, так и исходные продукты, которые потенциально могли бы вступить в реакцию. Следовательно, полнота сгорания не может быть 100%.
Согласно закону действующих масс скорость прямой реакции
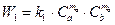 , (2.15)
, (2.15)
скорость обратной реакции равна
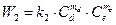 , (2.16)
, (2.16)
где W 1 и W 2 - скорости прямой и обратной реакции, k 1 и k 2 - константы пропорциональности (константы скоростей прямой и обратной реакций), Сa, Сb, Сd, Се, - концентрации реагирующих веществ, ma, mb, md и me - соответствующие стехиометрические коэффициенты.
Из уравнений (2.15) и (2.16) видно, что если концентрации реагирующих веществ изменяются во времени (например, в случае, когда количество исходных продуктов задано и не возобновляется), то скорости прямой и обратной реакции также являются функциями времени. Вначале скорость прямой реакции наибольшая, а скорость обратной реакции равна нулю, потому конечных продуктов еще нет. В дальнейшем скорость прямой реакции будет уменьшаться, а обратной - возрастать, так как концентрация конечных продуктов будет увеличиваться. Наступит момент, когда скорость обратной реакции станет равной скорости прямой реакции, т.е. наступит химическое равновесие.
Полнота сгорания топлива, т.е. полнота прямой реакции, определяется соотношением концентраций исходных веществ и конечных продуктов, создавшихся к моменту достижения химического равновесия. Найдем соотношение концентраций в момент равновесия.
Приравняем правые части уравнений (2.15) и (2.16)
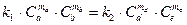
Откуда найдем соотношение констант
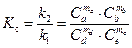 (2.17)
(2.17)
В этой формуле под Са и Сb подразумеваются концентрации веществ А и В, оставшиеся в системе при равновесии. К с - константа химического равновесия. Величина К с характеризует химическую неполноту сгорания.
В случае реакции горения, протекающей в газовой фазе, удобно выразить константу химического равновесия через парциальные давления
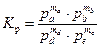 , (2.18)
, (2.18)
Можно показать, что 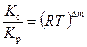 , где ∆ m=(md+me)-(ma+mb)=m2-m1. Значения К р для некоторых реакций приводятся в таблицах (см. [3, 9, 14] и др).
, где ∆ m=(md+me)-(ma+mb)=m2-m1. Значения К р для некоторых реакций приводятся в таблицах (см. [3, 9, 14] и др).
|
|