
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Параметры идеальных газовых смесей
|
|
Для идеальных газов давление р газовой смеси равняется сумме парциальных давлений рi, всех компонентов (закон Дальтона):
 . (1.1)
. (1.1)
Под парциальным давлением понимается давление, которое имел бы данный компонент, если бы он один занимал объем V смеси при температуре смеси Т.
На основании уравнения состояния
 , (1.2)
, (1.2)
где Сi - мольная концентрация i -го компонента; Rm - универсальная газовая постоянная.
Подставив pi в (1.1) и учитывая, что  - суммарная концентрация, получим, что смесь газов также подчиняется уравнению состояния
- суммарная концентрация, получим, что смесь газов также подчиняется уравнению состояния
 , (1.3)
, (1.3)
где vm - молярный объем. Задание газовых смесей путем относительной молярной концентрации
 . (1.4)
. (1.4)
Подставив сюда Сi и С из (1.2) и (1.3), получим
 . (1.4 ')
. (1.4 ')
Обозначим через Vi объем компонента i при давлении р и температуре Т. Тогда
 ,
,
Учитывая (1.3), получим
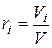 ,
,
где ri – относительная объемная доля i-го компонента.
Состав смеси можно характеризовать также массовыми долями разных компонентов:
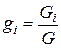 ,
,
где G - общая масса смеси в объеме V, Gi - масса компонента в том же объеме.
Установим связь между gi и ri. Для идеального газа
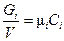 (1.5)
(1.5)
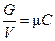 , (1.5 ')
, (1.5 ')
где m i - молекулярный вес компонента i, m - средний или кажущийся молекулярный вес смеси.
Суммируя уравнение (1.5) по i и сравнивая с (1.5 '), находим m:
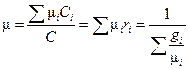 , (1.6)
, (1.6)
а, поделив уравнение (1.5) на (1.5 '), получим искомую связь между gi, и ri:
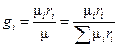 , или
, или  . (1.7)
. (1.7)
Для «весовой» концентрации, т. е. плотности ρ =С/m, уравнение состояния (1.3) принимает вид
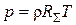 ,
,
где  - газовая постоянная смеси.
- газовая постоянная смеси.
|
|