
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакции твердое тело-газ
|
|
К реакциям твердых тел с газами прежде всего относятся многочисленные реакции оксидирования и сульфидирования. Типичные примеры:

Их часто называют реакциями образования окалины – пленок сульфидов или оксидов, покрывающих металлическую поверхность.
Кинетику подобных реакций рассмотрим на примере окисления.
Известны два вида оксидных слоев, различающихся по структуре - пористые и компактные плотные слои. Первые не препятствуют, а вторые, наоборот, препятствуют дальнейшему проникновению кислорода к поверхности металла. А от этого зависит и кинетика окисления, и расход металла, идущего на образование слоя оксида. Возникновение пористого слоя оксида определяется соотношением объемов оксида и металла 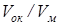 . Если
. Если 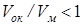 , то объем оксида не может заполнить объем, ранее занимавшийся металлом, и слой будет пористым. Если это соотношение > 1, то слой будет беспористым. Fe, Al, Cr и W покрыты тонкой прочной пленкой оксида. У щелочных и щелочноземельных металлов из-за
, то объем оксида не может заполнить объем, ранее занимавшийся металлом, и слой будет пористым. Если это соотношение > 1, то слой будет беспористым. Fe, Al, Cr и W покрыты тонкой прочной пленкой оксида. У щелочных и щелочноземельных металлов из-за 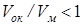 слои оксида рыхлые и не препятствуют доступу кислорода к неокисленному металлу. В этих случаях скорость окисления не зависит от толщины слоя L, а сам слой растет с постоянной скоростью
слои оксида рыхлые и не препятствуют доступу кислорода к неокисленному металлу. В этих случаях скорость окисления не зависит от толщины слоя L, а сам слой растет с постоянной скоростью  .
.
Такой характер роста показан прямой 1 (рис. 25) и описывается уравнением
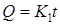 ,
,
где Q – масса оксидного слоя, растущего на единице площади металлической подложки; K1 º d L/ d t – константа.
Компактный, беспористый слой играет роль защитного барьера между внешней газовой средой и неокисленным металлом. Дальнейший рост этого слоя определяется двумя стадиями: 1) реакциями на поверхности раздела металл-оксид и оксид-кислород, 2) переносом реагирующего вещества (продуктов первой стадии) сквозь слой оксида. Скорость всего процесса определяется наиболее медленной из этих двух стадий.
В начале процесса вторая стадия отсутствует, а в конце, наоборот, именно она оказывается определяющей.
По мере окисления наступает момент, когда реакция на границе раздела достигает равновесия, тогда дальнейший процесс окисления идет по параболическому закону:
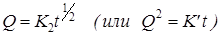 ,
,
где К2 – константа (кривая 2).
Помимо линейного и параболического законов, встречаются и другие кинетические кривые окисления.
При формировании очень тонких пленок наблюдается обратный логарифмический закон:
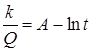 (кривая 4).
(кривая 4).
Утолщение оксида ZnO при не очень высоких температурах идет по логарифмическому закону (кривая 3):
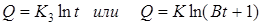 .
.
Известны также изменения режима, заключающиеся в переходе от параболического закона к линейному или паралинейному в промежуточной области.
К реакциям, в которых участвуют твердые вещества и газы, относятся и реакции разложения типа
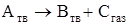 .
.
Такие реакции принято классифицировать по виду кривых степень разложение (давление газа С) – время разложения (рис. 26). Кривая 1 наблюдается у веществ (нитриды свинца, серебра), для которых очень велика скорость образования зародышей новой фазы, и поэтому поверхность быстро покрывается пленкой твердого продукта В.
Для других веществ (нитрид бария) характерен инкубационный период (кривая 2), связанный с малой скоростью образования зародышей новой фазы. И есть соединения (нитрид калия), при разложении которых выделяется небольшое количество газа, затем следует ускорение реакции, как на кривых 2 (кривая 3).
|
|