
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
II.1. Обратимые реакции
|
|
Обратимые реакции – реакции, протекающие как в прямом, так и в обратном направлениях. Например, реакции изомеризации в газовой фазе или в растворе: бутан ↔ изобутан, α -глюкоза ↔ β -глюкоза и др. Схема обратимой реакции первого порядка:
k1
А ↔ В
k-1
Для скорости такой реакции можно записать:
υ =υ 1- υ -1
где υ 1=k1CA, υ -1= k-1CB. Тогда:

или
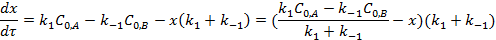
В состоянии равновесия 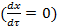 :
:
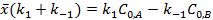
или
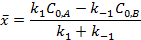
где 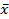 – количество вещества А, прореагировавшего до наступления равновесия.
– количество вещества А, прореагировавшего до наступления равновесия.
Тогда, в дифференциальном виде скорость реакции можно представить в виде выражения:
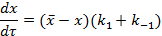
или
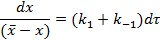
Интегральные формы кинетического уравнения:

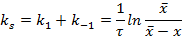
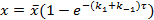
Так как, в состоянии равновесия υ 1=υ -1, то:

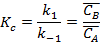
где 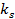 - суммарная константа скорости; Кс – концентрационная константа равновесия;
- суммарная константа скорости; Кс – концентрационная константа равновесия; 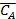 и
и 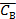 – равновесные концентрации веществ.
– равновесные концентрации веществ.
Константы скорости прямой и обратной реакций равны:
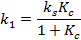
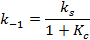
Зависимости концентрации веществ от времени для обратимой реакции первого порядка представлены на рисунке 5.
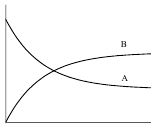
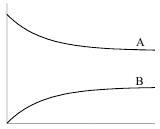
Кс> 1 Кс< 1
Рис. 5. Зависимость концентрации веществ А и В от времени для обратимой реакции первого порядка при Кс > 1 и Кс < 1.
|
|