
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
I.4. Влияние температуры на скорость реакций
|
|
В большинстве случаев повышение температуры приводит к увеличению скорости (и константы скорости) химической реакции. Аномальная зависимость константы скорости реакции от температуры наблюдается в некоторых реакциях третьего порядка, ферментативных и цепных реакциях:
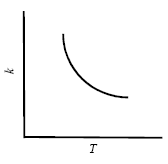
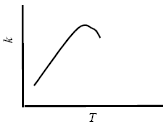

Скорость увеличивается, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения - правило Вант-Гоффа и уравнение Аррениуса.
Правило Я. Вант-Гоффа: при увеличении температуры на 100С скорость гомогенной реакции возрастает в 2-4 раза:
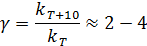
Величина γ - температурный коэффициент скорости (безразмерная величина) показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов.
Константа скорости зависит от температуры:

Правило Вант-Гоффа получено эмпирически и является приближенным. Значения температурного коэффициента не остаются постоянными при изменении температуры и стремятся к единице при высоких температурах. Поэтому правило можно использовать для полуколичественных оценок в области сравнительно низких температур. Более точно зависимость константы скорости от температуры передается уравнением Аррениуса
Уравнение С. Аррениуса:
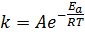
или в логарифмических координатах (рис. 4):
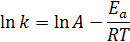
А – предэкспоненциальный множитель, который не зависит от температуры и определяется типом реакции. Физический смысл А в случае простых реакций: мономолекулярных - это частота колебаний по разрываемой связи (А» 1013 сек-1), бимолекулярных - величина А пропорциональна общему числу столкновений между молекулами реагирующих веществ (А» 10-10 ¸ 10-11 см3/(молекул·сек).
Еа - энергия активации химической реакции (кДж/моль) также не зависит от температуры. В случае простых реакций показывает, какой минимальной (избыточной по сравнению со средней) энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. В случае сложных реакций называется эмпирической или кажущейся энергией активации и в общем случае зависит от энергий активации отдельных стадий данной реакции.
Для большинства реакций в растворе Еа составляет 50 – 100 кДж/моль, реакции между валентнонасыщенными молекулами в газовой фазе характеризуются значениями 100 - 200 кДж/моль. Для реакций с участием активных частиц (свободные атомы, радикалы) энергия активации может составлять 0 – 10 кДж/моль.
Графическая зависимость константы скорости реакции от температуры представлена на рисунке.

При выводе уравнения Аррениус предположил, что реагировать (превращаться в продукты) могут не все молекулы, а лишь некоторые из них, находящиеся в особом активном состоянии. Эти молекулы образуются из обычных в эндотермическом процессе с поглощением энергии EA и роль температуры сводится к смещению равновесия в ту или иную сторону на этой стадии. Так, например, в реакции
A ® продукты
активные молекулы А* образуются из молекул А по схеме:
A ↔ A*
По Аррениусу, этот процесс является обратимым и быстрым, так что в системе всегда сохраняется термодинамическое равновесие между А и А*, которое можно характеризовать константой равновесия Kc:
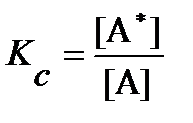 или [A*] = Kc[A].
или [A*] = Kc[A].
Превращение активных молекул в конечный продукт осуществляется со скоростью, не зависящей от температуры и относительно медленно:
[A*] ® B
Таким образом, скорость реакции равна (принцип лимитирующей стадии):
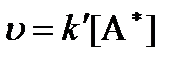
где k’ – константа скорости реакции (медленной стадии), не зависящая от температуры.
Подставляя величину концентрации активных молекул из выражения для термодинамической константы равновесия можно получить:
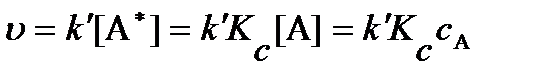 .
.
Так как k’ не зависит от температуры, то температурная зависимость константы скорости определяется уравнением изохоры Вант-Гоффа для константы равновесия:
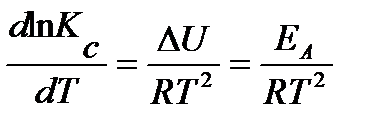 .
.
Интегрируя уравнение в предположении независимости энергии активации от температуры, получим выражение, совпадающее с эмпирическим уравнением Аррениуса:
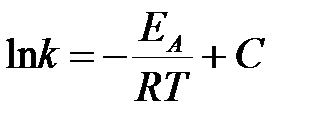 ,
,
где С – константа интегрирования.
Потенцируя уравнение, можно представить его в экспоненциальной форме, полагая eC = A:
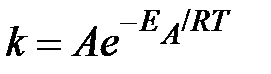 .
.
Для обратимой реакции:
k1
А ↔ В
k-1
разность энергий активации прямой и обратной реакций равна тепловому эффекту прямой реакции:
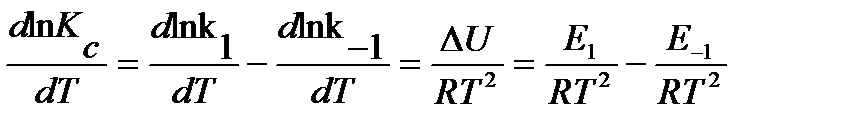
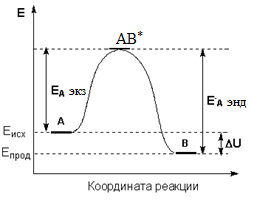
Энергию активации можно определить как аналитически по уравнению:
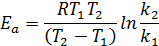
так и графическим методом. Для этого необходимо знать ряд констант скоростей при разных температурах. Если реакция подчиняется уравнению Аррениуса, то зависимость ln k от 1/ T должна выражаться прямой линией:
 Рис. 5. Зависимость ln k от 1/T
Рис. 5. Зависимость ln k от 1/T
|
Расчет по методу равных выходов (метод полупревращений) не требует знания констант. Если условия процесса (C0, A, α) при различных температурах одинаковы, то уравнение любого порядка реакции можно представить в виде:
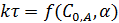
Так как правые части одинаковы, можно записать:
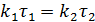
Таким образом, отношение констант можно заменить обратным отношением соответствующих времен:

Связь между энергией активации и температурным коэффициентом:
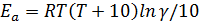
Чем больше энергия активации, тем меньше константа скорости, но тем быстрее она увеличивается с ростом температуры (больше значение температурного коэффициента).
|
|