
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз солей. Гидролиз солей - один из важных примеров гидролиза веществ
|
|
Гидролиз солей - один из важных примеров гидролиза веществ. Гидролиз - это реакция обменного разложения между различными веществами и водой.
Химическое обменное взаимодействие ионов растворённой соли с водой, приводящее к образованию слабого электролита и сопровождающееся изменением рН среды, называется гидролизом соли.
Вода —не только универсальный растворитель, но и химически активное вещество, она легко вступает в реакции с различными веществами.Вода – слабый электролит.В чистой воде концентрации ионов водорода и гидроксид-ионов равны. В растворах солей это равновесие нарушается, если соль образована слабым основанием или слабой кислотой.
Взаимодействие ионов растворимой соли с водой, приводящее к образованию слабого электролита и смещению ионного равновесия воды, называется гидролизом.
Гидролизу подвергаются лишь те соли, и в составе которых есть ион слабого основания (гидролиз по катиону) или слабой кислоты (гидролиз по аниону), так как только при этом условии образуется слабый электролит, «несвязанные» ионы воды создают в растворах солей либо кислую, либо щелочную среду.Изменение водородного показателя pH при растворении соли является основным признаком, указывающим на протекание гидролиза.
Для прогнозирования возможности гидролиза соли надо прежде всего проанализировать ее состав: установить, какими кислотой и основанием она образована. Соль может быть образована в соответствии со схемой:
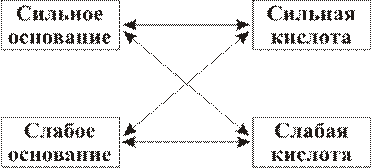
Различают несколько типов гидролиза солей.
1. Соли, образованные сильными основаниями (щелочами) и сильными кислотами, гидролизу не подвергаются, в их растворах нейтральная среда: pH = 7. К таким солям относятся: NaCl, Na2SO4, KNO3 и другие, например:
KNO3 + H2O ↔ KOH + HNO3
K+ + N 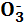 + H2O ↔ K+ + OH– + H+ + NO3
+ H2O ↔ K+ + OH– + H+ + NO3
H2O ↔ H+ + OH–
2. Соли, образованные сильными основаниями (щелочами)и слабыми кислотами, гидролизуются по аниону, так как анион образует с ионами водорода слабую кислоту.Среда в таких растворах щелочная (pH> 7)К таким солям относятся: NaF, CH3COONa, K2S, K3PO4, NaClO, LiNO2 и другие.
КСN + Н2О ↔ НСN + КОН
СN‾ + Н2О ↔ НСN + ОН ‾
В результате гидролиза в растворах таких солей образуются гидроксид-ионы и раствор приобретает щелочную реакцию (рН > 7).
Гидролиз солей, образованных катионом сильного основания и многозарядным анионом слабой кислоты, например, Na2СО3, К2S. Гидролиз таких солей протекает ступенчато, причем гидролиз идет в основном по первой ступени. Продуктами первых ступеней гидролиза являются кислые соли:
1 ступень К2S + Н2О ↔ КНS + КОН
S2- + Н2О ↔ НS‾ + ОН‾
2 ступень КНS + Н2О ↔ Н2S + КОН
НS- + Н2О ↔ Н2S + ОН‾
Гидролиз солей, образованных сильными основаниями и слабыми кислотами, обратим. Равновесие гидролиза можно смещать. Согласно принципу Ле-Шателье для подавления гидролиза в данном случае следует добавить сильной щелочи (возрастет концентрация одного из продуктов реакции). Для увеличения степени гидролиза следует, наоборот, добавить кислоту, повысить температуру раствора (гидролиз — эндотермический процесс) или разбавить раствор (увеличить концентрацию исходного вещества — воды).
3. Гидролиз солей, образованных однозарядным катионом слабого основания и анионом сильной кислоты, например, NН4Cl, АgNО3.
NН4Cl + Н2О ↔ NН4ОН + НСl
NН4+ + Н2О ↔ NН4ОН + Н+
В результате гидролиза в растворах таких солей образуются ионы Н+ и раствор приобретает кислую реакцию (рН < 7).
Гидролиз солей, образованных многозарядным катионом слабого основания и анионом сильной кислоты, например, ZnСl2, АlI3. Гидролиз таких солей протекает ступенчато, причём продуктами первых ступеней гидролиза являются основные соли:
1 ступень Cu(NO3)2 + Н2О ↔ СuOНNО3 + НNО3
Cu2+ + Н2О ↔ Cu(ОН)+ + Н+
2 ступень Cu(ОН)NО3 + Н2О ↔ Сu(ОН)2 + НNО3
Сu(ОН)+ + Н2О ↔ Cu(ОН)2 + Н+
Растворы этих солей имеют, кислую реакцию. В холодных и умеренно концентрированных растворах солей гидролиз их практически ограничивается первой ступенью. При повышении температуры растворов, а также по мере их разбавления гидролиз солей усиливается и может протекать по второй ступени. В случае трёхзарядных катионов третья ступень гидролиза практически не протекает (ввиду накопления ионов водорода процесс смещается в сторону исходных веществ), но иногда, например, при добавлении по каплям раствора FеСl3 в кипящую воду идёт третья стадия гидролиза и образуется Fе(ОН)3:
Fе(ОН)2+ + Н2О ↔ Fе(ОН)3 + Н+
Гидролиз солей, образованных слабыми основаниями и сильными кислотами, также обратим. Равновесие гидролиза можно смещать. Согласно принципу Ле-Шателье для подавления гидролиза в данном случае следует добавить сильной кислоты (возрастет концентрация одного из продуктов реакции). Для увеличения степени гидролиза следует, наоборот, добавить щелочи, нагреть раствор (гидролиз — эндотермический процесс) или разбавить его (увеличить концентрацию исходного вещества — воды).
4. Гидролиз солей, образованных слабым основанием и слабой кислотой. В зависимости от зарядности катиона и аниона при гидролизе солей, образованных слабым основанием и слабой кислотой, могут образоваться слабое основание и слабая кислота:
NН4F + Н2О ↔ NН4ОН + НF
NН4+ + F‾ + Н2О ↔ NН4ОН + НF
или слабая кислота и основная соль (если катион многозарядный):
Fе(СН3СОО)3 + Н2О ↔ СН3СООН + FеОН(СН3СОО)2
Fe3+ + 3СН3СОО‾ + Н2О ↔ СН3СООН + (FеОН)2+ + 2СН3СОО‾
или слабое основание и кислая соль (если анион многозарядный):
(NН4)2S + Н2О ↔ NН4ОН + NН4НS
2NН4+ + S2- + Н2О ↔ NН4ОН + NН4+ + НS‾
При гидролизе солей, образованных слабым основанием и слабой кислотой, рН раствора может быть равен ≈ 7, если образующаяся кислота и основание примерно одинаковы по силе.
Соли, образованные очень слабыми основаниями или амфотерными гидроксидами (Cr(OH)3, Al(OH)3) и слабыми кислотами (H2S, H2CO3), подвергаются гидролизу и по катиону (катиону слабого основания), и по аниону (аниону слабой кислоты). Гидролиз таких солей происходит практически необратимо, если выделяется газ или осадок, либо если то и другое образуется одновременно. В таблице растворимости такие соли отмечены прочерком.
Например, при внесении в воду сульфида алюминия или карбоната алюминия мгновенно происходит полный необратимый гидролиз соли, в результате которого выпадает в осадок амфотерный гидроксид алюминия Al(OH)3 и выделяется газ — сероводород H2S или углекислый газ CO2:
Аl2S3 + 6Н2О = 2Аl(ОН)3  + 3Н2S
+ 3Н2S 
Аl2(CО3)3 + 6Н2О = 2Аl(ОН)3 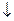 + 3Н2О + 3СО2
+ 3Н2О + 3СО2 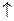
Поэтому сульфиды и карбонаты таких элементов могут быть получены только сухим путём, так как при взаимодействии с водой они полностью разлагаются.
Более сложно проходит гидролиз карбонатов двухзарядных катионов. При сливании двух растворов, один из которых содержит карбонат- ион, а другой – ион двухзарядного металла, в результате гидролиза образуется основная соль:
2ВеSО4 + 2Nа2СО3 + Н2O ↔ (Ве ОН)2СО3 + 2Nа2SО4 + СО2
Если к раствору соли, которая гидролизуется по аниону, добавить раствор соли, которая подвергается гидролизу по катиону, то будет наблюдаться совместный гидролиз. Например, при сливании растворов карбоната натрия и хлорида алюминия наблюдается выпадение осадка гидроксида алюминия и выделение углекислого газа:
3Na2CO3 + 2AlCl3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl
6Na++3CO32–+2Al3++6Cl–+3H2O = 2Al(OH)3↓ +3CO2↑ +6Na++6Cl–
3CO32– + 2Al3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑
Нерастворимые в воде соли гидролизу практически не подвергаются.
Ионы трёхзарядных металлов (Аl3+, Fе3+, Сr3+) при участии карбонат-ионов подвергаются полному гидролизу.
Сr2(CО3)3 + 6Н2О = 2Сr(ОН)3 + 3Н2СО3
Константа гидролиза и степень гидролиза солей. Количественно гидролиз можно охарактеризовать с помощью константы гидролиза и степени гидролиза.
Степень гидролиза (aг) есть отношение числа молекул, подвергающихся гидролизу, к общему числу молекул в растворе. Степень гидролиза зависит от природы растворённого вещества, от концентрации (чем меньше концентрация вещества, тем больше степень гидролиза), от температуры (с увеличением температуры степень гидролиза увеличивается).
|
|