
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз солей слабых оснований и слабых кислот.
|
|
В этом случае в реакции одновременно участвуют и катион, и анион соли, связывающие ионы OH- и H+ из воды.
В качестве примера рассмотрим гидролиз соли CH3COONH4. Уравнение диссоциации соли:
CH3COONH4 = NH4+ + CH3COO-.
Краткое ионное и молекулярное уравнения реакции гидролиза:
CH3COONH4 + H2O < ==> NH4OH + CH3COOH;
NH4+ + CH3COO- + HOH < ==> NH4OH + CH3COOH.
Значение рН растворов таких солей зависит от относительной силы кислоты и основания, образующих соль. Константы диссоциации уксусной кислоты и гидроксида аммония равны:  и
и 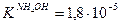 , поэтому реакция раствора данной соли нейтральная.
, поэтому реакция раствора данной соли нейтральная.
В общем случае,
если 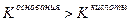 , реакция раствора соли слабощелоч-ная, pH незначительно больше семи,
, реакция раствора соли слабощелоч-ная, pH незначительно больше семи,
если 
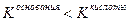 , реакция раствора соли слабокислая, pH незначительно меньше семи,
, реакция раствора соли слабокислая, pH незначительно меньше семи,
если  , реакция раствора соли нейтральная pH равен 7.
, реакция раствора соли нейтральная pH равен 7.
Соли многоосновных слабых кислот и многокислотных слабых оснований гидролизованы в растворе полностью, с образованием кислоты и основания:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Такие соли в водных растворах существовать не могут.
|
|