
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз солей
|
|
Лекция 9
Гидролиз – это разложение веществ водой. Соли, как и другие вещества, изменяют реакцию водного раствора, претерпевая гидролиз (от греч. 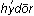 – вода и
– вода и 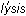 – разложение). Причиной его является электролитическая диссоциация и соли, и воды на ионы, и взаимодействие между ними. Вода диссоциирует незначительно на ионы Н+ и ОН– (1 молекула из 550 000), причем в процессе гидролиза один или оба этих иона могут связываться с ионами, образующимися при диссоциации соли, в малодиссоциирующее, летучее или нерастворимое в воде вещество. На практике особенно часто приходится иметь дело с гидролизом солей. Естественно предположить, что растворы средних солей, которые являются продуктами полного замещения протонов в молекулах кислот катионами металла, должны иметь нейтральную реакцию среды. Однако это предположение оказывается справедливым только в отношении солей, образованных сильными кислотами и сильными основаниями. Поскольку соль состоит из катиона и аниона, то возможны три типа гидролиза: гидролиз по катиону (в реакцию с водой вступает только катион); гидролиз по аниону (в реакцию с водой вступает только анион); совместный гидролиз (в реакцию с водой вступает и катион, и анион).
– разложение). Причиной его является электролитическая диссоциация и соли, и воды на ионы, и взаимодействие между ними. Вода диссоциирует незначительно на ионы Н+ и ОН– (1 молекула из 550 000), причем в процессе гидролиза один или оба этих иона могут связываться с ионами, образующимися при диссоциации соли, в малодиссоциирующее, летучее или нерастворимое в воде вещество. На практике особенно часто приходится иметь дело с гидролизом солей. Естественно предположить, что растворы средних солей, которые являются продуктами полного замещения протонов в молекулах кислот катионами металла, должны иметь нейтральную реакцию среды. Однако это предположение оказывается справедливым только в отношении солей, образованных сильными кислотами и сильными основаниями. Поскольку соль состоит из катиона и аниона, то возможны три типа гидролиза: гидролиз по катиону (в реакцию с водой вступает только катион); гидролиз по аниону (в реакцию с водой вступает только анион); совместный гидролиз (в реакцию с водой вступает и катион, и анион).
Соли, образованные сильными основаниями (NаОН, КОH, Ва(ОH)2) и сильными кислотами (Н2SO4, HCl, НNO3), гидролизу не подвергаются, т.к. образующие их катионы и анионы не способны в растворах связывать ионы Н+ и ОН– (причина – высокая диссоциация). Когда соль образована слабым основанием или слабой кислотой или оба «родителя» – слабые, соль в водном растворе подвергается гидролизу. При этом реакция среды зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут быть нейтральными, кислыми или щелочными в зависимости от констант диссоциации образующихся новых веществ. Реакции гидролиза в одних случаях являются обратимыми, а в других – идут до конца.
Уравнение гидролиза соли записывают в два этапа:
1) диссоциация соли в растворе − необратимая реакция (α = 1); 2) гидролиз иона соли (его взаимодействие с водой) − обратимая реакция (α < 1).
Этапы 1 и 2 складывать нельзя!
Пример 1. Гидролизсоли, образованной катионом слабого основания и анионом сильной кислоты (сульфата меди(II))
1. Определяем тип гидролиза. Привести уравнение диссоциации соли:
CuSO4 = Cu 2+ + SO42-.
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по иону слабого электролита, т.е. по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu2+ + H–OH = CuOH+ + H+ (pH< 7).
Образуется катион гидроксомеди(II) и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, составляются нейтральные частицы, существующие только на бумаге. В данном случае можно составить формулу (CuOH)2SO4, но для этого ионное уравнение мысленно умножается на два:
2CuSO4 + 2H2O = (CuOH)2SO4 + H2SO4.
Продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль называется «сульфат гидроксомеди(II)».
Гидролиз солей слабых многоосновных оснований и/или кислот происходит ступенчато. Число ступеней гидролиза равно наибольшему заряду одного из ионов соли. Например: гидролиз Nа2СО3 происходит в 2 ступени, Al2(SО4)3 – в 3, а Co(CH3COO)2 в 2.
Однако гидролиз по второй ступени и особенно по третьей идет очень слабо. Поэтому при написании уравнений гидролиза обычно ограничиваются первой ступенью. Если гидролиз практически завершается на первой ступени, то при гидролизе солей слабых многоосновных оснований и сильных кислот образуются основные соли, а при гидролизе солей сильных оснований и слабых многоосновных кислот образуются кислые соли.
Соли, образованные катионами, сильно подверженными гидролизу (такие как Sn2+ или Bi3+), удается растворить только при добавлении кислоты; при растворении в чистой воде гидроксокатионов получается настолько много, что соответствующая основная соль выпадает в осадок:
SnCl2 + H2O = Sn(Cl)OH↓ + HCl
Bi(NO3)3 + H2O = Bi(NO3)2OH↓ + HNO3
Итак, соли, образованные катионом малорастворимого основного или амфотерного гидроксида и анионом сильной кислоты, подвергаются гидролизу по катиону и образуют в растворе кислотную среду. Например, при добавлении к раствору хлорида сурьмы(III) дистиллированной воды наблюдается образование осадка SbOCl, что свидетельствует о протекании реакции гидролиза соли SbCl3 по второй ступени. Именно вторая ступень гидролиза хлорида сурьмы(III) приводит к образованию основной соли Sb(ОН)2Сl, разложение которой и дает осадок хлорида оксосурьмы. Таким образом, разбавляя раствор, смещаем равновесие реакции гидролиза в сторону образования продуктов реакции.
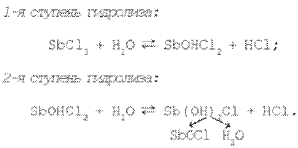
Так, если к раствору с осадком SbОСl прилить соляную кислоту, то осадок растворится. Если затем вновь в раствор добавить воду, то наблюдается повторное образование осадка.
Описанное явление подтверждает обратимый характер процесса и возможность смещения химического равновесия реакции гидролиза.
Пример 2. Гидролизсоли, образованной катионом сильного основания и анионом слабой кислоты (ортофосфата рубидия).
1. Определяем тип гидролиза:
Rb3PO4 = 3Rb+ + PO 43–.
Рубидий – щелочной металл, его гидроксид – сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, – слабая кислота. Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:
PO43–+ H–OH = HPO42– + OH– (pH> 7).
Продукты – гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Rb3PO4 + H2O = Rb2HPO4 + RbOH.
Получили кислую соль – гидрофосфат рубидия.
Особенно сильно идет гидролиз солей, образованных одновременно слабыми основанием и кислотой. Но даже для них степень гидролиза обычно не превышает 1%.
Пример 3. Гидролизсоли, образованной катионом слабого основания и анионом слабой кислоты (ацетата алюминия).
1. Определяем тип гидролиза:
Al(CH3COO)3 = Al 3+ + 3 CH 3 COO –.
Соль образована катионом слабого основания и анионами слабой кислоты. Идет совместный гидролиз.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al3+ + H–OH = AlOH2+ + H+,
CH3COO– + H–OH = CH3COOH + OH– pH раствора зависит от относительной силы кислоты и основания.
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону. Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3. Составляем молекулярное уравнение:
Al(CH3COO)3 + H2O = AlOH(CH3COO)2 + CH3COOH.
Получили основную соль – ацетат гидроксоалюминия.
|
|