
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. Растворы - это гомогенные (состоящие из одной фазы) системы, содержащие несколько компонентов
|
|
Растворы - это гомогенные (состоящие из одной фазы) системы, содержащие несколько компонентов. Растворы бывают газообразные, жидкие и твердые. Среди соединений (компонентов), образовавших раствор, выделяют растворенные вещества и растворитель.
Растворителем принято считать компонент, агрегатное состояние которого соответствует агрегатному состоянию раствора. Как правило, это компонент, содержание которого в растворе выше содержания остальных, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности – водные растворы, в которых растворителем является вода.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Состав раствора и содержание растворенного вещества (концентрация) выражаются различными способами.
1. Массовая доля компонента w i - это отношение массы i- го компонента mi к массе раствора S mi:
w i = mi / S mi, (1)
w i - безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100% (в последнем случае говорят о процентной концентрации по массе).
2. Молярная доля компонента Хi - это отношение числа молей i -го компонента ni к сумме молей å n i всех компонентов, образующих раствор, безразмерная величина:
Хi = ni / å n i. (2)
3. Моляльная концентрация растворенного вещества, или моляльность, Сm - число молей растворенного вещества n, приходящихся на 1 кг растворителя, моль/кг:
Сm = n / ms = 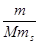 , (3)
, (3)
где m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms - масса растворителя (кг).
4. Молярная концентрация растворенного вещества, или молярность, С - число молей растворенного вещества n в 1 л раствора, моль/л, или, сокращенно, М:
С = n / V = 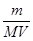 , (4)
, (4)
где V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
5. Молярная концентрация эквивалента растворенного вещества, или нормальная концентрация, или нормальность, Сэкв - число молей эквивалентов растворенного вещества n экв в 1 л раствора, моль экв/л, или, сокращенно, н.:
С экв= n экв/ V =  =
= 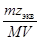 , (5)
, (5)
где М экв – молярная масса эквивалента растворенного вещества (г/моль экв); z экв – число эквивалентности растворенного вещества; V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
6. Массовая концентрация Смасс – масса растворенного вещества m в 1 л раствора, г/л:
С масс = m / V, (6)
где V - объем раствора (л).
7. Титр Т – масса растворенного вещества в 1 мл раствора, г/мл.
Т = С масс/1000
Можно применять и другие способы выражения состава раствора.
Для приготовления раствора заданной концентрации взвешивают необходимые массы (отмеряют необходимые объемы) чистых компонентов раствора. В химических аналитических лабораториях используют концентрированные растворы известной концентрации: фиксаналы – растворы, помещенные в герметичные ампулы заводского производства, содержащие строго определенное (обычно 0, 1 моль) количество химического соединения. При расчете масс (объемов) компонентов учитывают (см. Табл.1) соотношения между различными способами выражения состава раствора.
Таблица 1.
Соотношения между различными способами выражения состава бинарного раствора (r - плотность раствора данного состава, г/л)
| w | С | С экв | Сm | С масс | |
| w | - | С= 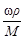
| С экв= 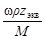
| Сm= 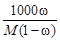
| С масс = w r |
| С | w = 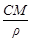
| - | С экв= Сz экв | Сm= 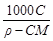
| С масс = СМ |
| С экв | w = 
| С= 
| - | Сm= 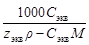
| С масс = Сэкв 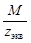
|
| Сm | w = 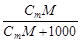
| С= 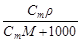
| С экв= 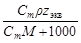
| - | С масс = 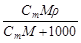
|
| С масс | w = 
| С= 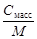
| С экв= 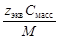
| Сm= 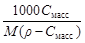
| - |
Установление состава раствора является одной из задач аналитической химии. Количественный анализ проводят физическими, химическими и физико-химическими методами. Одним из наиболее простых среди них является титриметрия.
Титриметрия – аналитический метод, основанный на измерении объема раствора реагента точно известной концентрации, взаимодействующего с определяемым веществом. Растворы реагентов известной концентрации, используемые в титриметрии, называют титрованными (стандартными) растворами, или титрантами.
Принцип титрования: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют небольшими порциями раствор титранта до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования). Момент окончания титрования можно установить при помощи химической реакции или по изменению некоторого физического свойства. Часто используются органические красители, окраска которых изменяется по достижении конечной точки титрования (см. табл.2).
Таблица 2.
|
|