
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Зависимость давления насыщенного водяного пара от температуры
|
|
| t, 0 С | мм рт.ст. | Па | t, 0 С | мм рт.ст. | Па |
| 1705, 1 | 12, 79 | 2809, 0 | 21, 07 | ||
| 1817, 1 | 13, 63 | 2983, 7 | 22, 38 | ||
| 1947, 1 | 14, 53 | 3167, 2 | 23, 76 | ||
| 2063, 8 | 15, 48 | 3361, 0 | 25, 21 | ||
| 2197, 1 | 16, 48 | 3564, 9 | 26, 74 | ||
| 2337, 8 | 17, 53 | 3779, 6 | 28, 35 | ||
| 2486, 4 | 18, 65 | 4004, 9 | 30, 04 | ||
| 2643, 7 | 19, 83 | 4242, 2 | 31, 82 |
Преобразуем уравнение (5), подставив известные численные данные:
Мэкв = 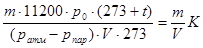 (6),
(6),
где K =  (7)
(7)
Коэффициент K зависит только от условий опыта (p, T) и размерности давления. Так как этот коэффициент не зависит от массы металла, то его можно рассчитать заранее и использовать при повторных измерениях.
После расчета молярной массы эквивалента металла по уравнению (6) рассчитывается молярная масса металла для трех значений валентности Z, равных 1, 2 и 3 по уравнению: M =M экв ·Z (8)
По таблице Д. И. Менделеева выбирается металл, проявляющий соответствующую валентность, для которого расхождение расчетной величины молярной массы с табличной не превышает 1 –2 г/моль.
Затем рассчитывается относительная погрешность опыта по уравнению:
Δ M = 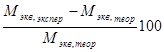 % (9),
% (9),
где М экв, экспер – молярная масса эквивалента металла, рассчитанная из опытных данных по уравнению (6), М экв, теор – теоретическая молярная масса эквивалента металла, рассчитанная по уравнению (8).
Контрольные вопросы и задачи для защиты лабораторной работы
1-10. Рассчитать молярную массу эквивалента
| № | Элемент | Соединение | Ион |
| Li | MnO(OH)2 | SO32- | |
| Al | CrO3 | ClO4- | |
| Ba | Al2(SO4)3 | UO2+ | |
| Si | Mn2O7 | PO43- | |
| Na | Cr2O3 | [PtCl6]2- | |
| Ca | UO2 | SO42- | |
| B | P2O5 | Cr2O72- | |
| C | PCl5 | S2- | |
| P | SO2 | HPO42- | |
| Sr | H3PO4 | Cr3+ |
11-20. Рассчитать эквивалентное число и молярную массу эквивалента окислителя и восстановителя по данным схемам химических реакций
| № задачи | Исходные вещества | Продукты реакции |
| KMnO4, Na2SO3 | K2MnO4, Na2SO4 | |
| HNO3, Mg | Mg2+, N2 | |
| I2, I2 | I-, IO3- | |
| HNO3, Zn | NH4NO3, Zn2+ | |
| KMnO4, Na2SO3 | MnSO4, Na2SO4 | |
| K2Cr2O7, KI | Cr3+, I2 | |
| HNO3, Cu | NO, Cu2+ | |
| H2SO4, Mg | MgSO4, H2S | |
| KMnO4, Na2SO3 | MnO(OH)2, Na2SO4 | |
| HNO3, Ca | N2O, Ca2+ |
21-30. Рассчитать молярную массу эквивалента металла по нижеприведенным данным.
| № задачи | Масса металла, вступившего в реакцию (г) | Полученное соединение и его масса (г) |
| 0, 347 | Сульфит, 4, 347 | |
| 1, 635 | Хлорид, 3, 41 | |
| 7.82 | Сульфат, 17, 42 | |
| 1, 73 | Нитрат, 7, 93 | |
| 1, 8 | Фторид, 5, 6 | |
| 5, 395 | Оксид, 5, 795 | |
| 6, 075 | Гидрофосфат, 30, 075 | |
| 4, 6 | Гидросульфат, 24 | |
| 1, 59 | Гидроксид, 2, 44 | |
| 4, 0 | Сульфид, 7, 2 |
31-40. Рассчитать массу полученного вещества из данных исходных веществ, используя закон эквивалентов.
| № | Объем вступившего в реакцию газа (н. у.), л | Продукт реакции |
| Cl2, 3, 8 | FeCl2 | |
| SO2, 4, 6 | K2SO3 | |
| O2, 7, 4 | CuO | |
| F2, 6, 4 | AlF3 | |
| SO3, 16, 8 | Na2SO4 | |
| Cl2, 8, 2 | NiCl2 | |
| SO2, 2, 7 | Li2SO3 | |
| O2, 3, 5 | Cr2O3 | |
| F2, 14, 7 | AgF | |
| SO3, 11, 4 | CaSO4 |
|
|