
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Коллоквиум 5.
|
|
Гетерогенное равновесие.
Вопросы к коллоквиуму.
1. Гомогенные и гетерогенные системы. Определение фазы по Гиббсу и Ван дер Вальсу. Понятие составляющей и компонента. Число степеней свободы гетерогенной системы.
2. Условие гетерогенного равновесия в двухфазной двухкомпонентной системе без протекания химических реакций. Условие гетерогенного равновесия в полифазной многокомпонентной системе без протекания химических реакций - система уравнений Гиббса.
3. Правило фаз Гиббса и его вывод.
4. Фазовые переходы и их термодинамическая классификация по Эренфесту. Фазовые переходы первого и второго рода. Графическое изображение фазовых переходов.
5. Уравнение фазовых переходов Клаузиуса-Клапейрона и его вывод. Различные формы уравнения фазовых переходов Клаузиуса-Клапейрона.
6. Геометрическая термодинамика и диаграммы состояния. Термодинамическое обоснование диаграмм состояния однокомпонентных систем.
7. Примеры диаграмм состояния однокомпонентных систем: воды, углекислого газа, серы, и фосфора. Обратимые и необратимые фазовые переходы в однокомпонентных системах: энантиотропия и монотропия.
8. Термодинамическое обоснование диаграмм состояния двухкомпонентных систем. Различные примеры диаграмм состояния двухкомпонентных систем без образования химических соединений: с неограниченной растворимостью в твердом и жидком состоянии; с ограниченной растворимостью в твердом состоянии (эвтектического и перитектического типа).
9. Термодинамическое обоснование диаграмм состояния двухкомпонентных систем. Различные типы диаграмм состояния двухкомпонентных систем с образованием химических соединений, плавящихся конгруэнтно и инконгруэнтно.
Вопросы для самоконтроля.
1. Что называется компонентом гетерогенной системы?
2. Что называется числом степеней свободы? Как оно вычисляется?
3. Определите число компонентов в системе, в которой протекает гетерогенная реакция NH4Cl(т) = NH3(г) + HCl(г).
4. Что называется диаграммой состояния однокомпонентной системы?
5. Сколько фаз находится в равновесии в данной фигуративной точке на диаграмме состояния однокомпонентной системы, если число степеней свободы в этой точке равно 1.
6. Какому уравнению подчиняются моновариантные равновесия однокомпонентной системы.
7. Чем можно объяснить взаимное расположение моновариантных линий в окрестностях тройной точки на диаграмме состояния однокомпонентной системы?
8. Почему линия плавления может иметь как положительный, так и отрицательный наклон на диаграмме состояния однокомпонентной системы?
9. Почему линия плавления имеет всегда больший наклон, чем линии сублимации и испарения в окрестностях тройной точки на диаграмме состояния однокомпонентной системы?
10. Почему линия сублимации имеет всегда больший наклон, чем линия испарения в окрестностях тройной точки на диаграмме состояния однокомпонентной системы?
11. Чем всегда заканчивается линия испарения на диаграмме состояния однокомпонентной системы?
12. Под давлением 26600 Па циклогексан и этилацетат кипят при одинаковой температуре. Почему при нормальном давлении температура кипения первого из них выше температуры кипения второго на 3.6°C?
13. Нормальные температуры кипения бензола, нафталина и четыреххлористого углерода соответственно равны 353.3, 491.1 и 349.9 K. В каком соотношении находятся для этих веществ мольные величины энтропии испарения при нормальной температуре кипения?
14. Объясните, почему при нагревании на воздухе лед плавится, а кристаллический йод возгоняется?
15. Зависимость давления насыщенного пара фреона CCl2F2 от температуры выражается уравнением 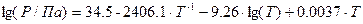 .
.
Рассчитайте при температуре 298 K давление насыщенного пара и изменение энтропии при испарении 1 моль фреона при этой же температуре.
16. Изобразите диаграмму состояния воды. Определите температуру кипения воды при общем давлении, равном 2 атм, если удельная теплота испарения воды λ исп =2254.8 Дж/г?
17. Простое вещество A существует в трех агрегатных состояниях: твердом, жидком и газообразном. Изобразите схематически диаграмму состояния этого простого вещества вблизи тройной точки, если мольные энтропии и объемы фаз находятся в следующих соотношениях 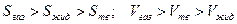 .
.
18. Давление насыщенного пара над твердым и жидким цинком выражается уравнениями
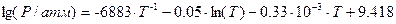
и
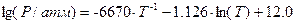 соответственно.
соответственно.
Определите, какая из фаз будет термодинамически более устойчивой при температуре 680 K? Ответ обосновать аналитически и графически.
19. Постройте фазовую диаграмму бензола вблизи тройной точки с координатами P=36 мм.рт.ст. и T=5.50°С с использованием следующих данных: Δ Hпл=10.6 кДж/моль, Δ Hисп=30.8 кДж/моль, плотность твердого и жидкого бензола ρ тв=0.891 г/см3 и ρ ж=0.879 г/см3 соответственно.
20. Схематически изобразите диаграмму состояния двухкомпонентной системы A-B в координатах«T-xB» по следующим данным:
В системе существует единственное трехфазное равновесие эвтектического типа при температуре Tэвт.
В системе образуются граничные твердые растворы на основе компонентов A и B - α и β соответственно. Максимальная растворимость вторых компонентов в этих растворах соответствует эвтектической температуре и составляет 20 мольных процентов как для α, так и для β.
21. Схематически изобразите диаграмму состояния двухкомпонентной системы A-B в координатах«T-xB» по следующим данным:
В системе существует единственное трехфазное равновесие перитектического типа L(ж)+ β (тв)= α (тв) при температуре Tпер.
В системе образуются граничные твердые растворы на основе компонентов A и B - α и β соответственно. Максимальная растворимость компонента A в растворе β соответствует перитектической температуре и составляет 10 мольных процентов. Максимальная растворимость компонента B в растворе α соответствует перитектической температуре и составляет 20 мольных процентов.
22. Схематически изобразите диаграмму состояния двухкомпонентной системы A-B в координатах«T-xB» по следующим данным:
В системе образуются два химических соединения постоянного состава A3B и AB2. Первое из которых плавится инкогруэнтно согласно схеме A3B=L(ж) + α (тв), а второе – конгруэнтно.
В системе образуются граничные твердые растворы на основе компонентов A и B - α и β соответственно. Максимальная растворимость компонента A в растворе β соответствует перитектической температуре Tпер и составляет 20 мольных процентов. Максимальная растворимость компонента B в растворе α соответствует температуре инконгруэнтного плавления A3B и составляет 10 мольных процентов.
В системе существует трехфазное равновесие перитектического типа L(ж) + AB2(тв)=β (тв) при температуре Tпер.
В системе существует трехфазное равновесие эвтектического типа L(ж)= A3B(тв)+AB2(тв) при температуре Tэвт, которая превышает Tпер, но меньше температуры инконгруэнтного плавления A3B. Состав эвтектического расплава соответствует xB =0.5.
Нанесите на рисунок три фигуративных точки в области однофазного расплава с xB =0.2, xB =0.5 и xB =0.75 и из этих точек постройте кривые охлаждения.
23. Схематически изобразите диаграмму состояния двухкомпонентной системы A-B в координатах«T-xB» по следующим данным:
В системе образуются два химических соединения постоянного состава A3B и AB2, плавящиеся инкогруэнтно согласно схемам A3B(тв)=L(ж) + α (тв) и AB2(2)(тв)=L(ж) + A3B(тв).
В системе образуются граничные твердые растворы на основе компонентов A и B - α и β соответственно. Максимальная растворимость компонента A в растворе β соответствует перитектической температуре Tпер и составляет 20 мольных процентов. Максимальная растворимость компонента B в растворе α соответствует температуре инконгруэнтного плавления A3B и составляет 10 мольных процентов.
В системе существует трехфазное равновесие перитектического типа L(ж) + AB2(тв)=β (тв) при температуре Tпер.
Соединение AB2 претерпевает полиморфное превращение AB2(1)(тв)= AB2(2)(тв) при Tп.п., которая лежит между Tпер и температурой его инконгруэнтного плавления.
Нанесите на рисунок три фигуративных точки в области однофазного расплава с xB =0.2, xB =0.5 и xB =0.75 и из этих точек постройте кривые охлаждения.
|
|