
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
И растворами солей
|
|
Тепло- и массообмен между воздухом и жидкостью является ком-
плексным процессом, при котором одновременно происходит перенос теп-
лоты и массы вещества. Интенсивность потоков теплоты и массы вещества как в толще жидкости, так и над ее поверхностью зависит от градиентов потенциалов переноса. При этом поток теплоты зависит от градиента температуры, а поток массы – от градиента, например, концентрации вещества. Вместе с тем градиент концентрации оказывает влияние на интенсивность потока теплоты, а градиент температуры, в свою очередь, – на интенсивность потока массы.
При рассмотрении тепло- и массообмена применительно к процессам кондиционирования воздуха особый интерес представляеттепловлажностное состояние сред на границе раздела «воздух – жидкость». От разности потенциалов переноса между массой воздуха и поверхностью, а также между поверхностью и массой жидкости зависит интенсивность тепло- и массообмена, и, соответственно, интенсивность процесса изменения состояния воздуха. Парциальное давление паров над водой зависит от температуры ее поверхности. Это связано с тем, что силы поверхностного натяжения удерживают отдельные молекулы в массе жидкости. В то же время некоторые молекулы приобретают энергию, превышающую их средний энергетический уровень, и покидают поверхность.
Некоторые молекулы, находящиеся над поверхностью и обладающие энергией ниже среднего для данной температуры уровня, поглощаются по-
верхностью. Таким образом устанавливается равновесное состояние. Если в системе «чистая жидкость – воздух» все молекулы жидкости обладают одинаковой возможностью покинуть поверхность (рис. 3.11), то в системе «раствор соли – воздух» ситуация несколько иная (рис. 3.12). Молекулы растворителя обладают возможностью покидать поверхность и поглощаться ею, а молекулы растворенного вещества (нелетучие соли) не обладают такой способностью.
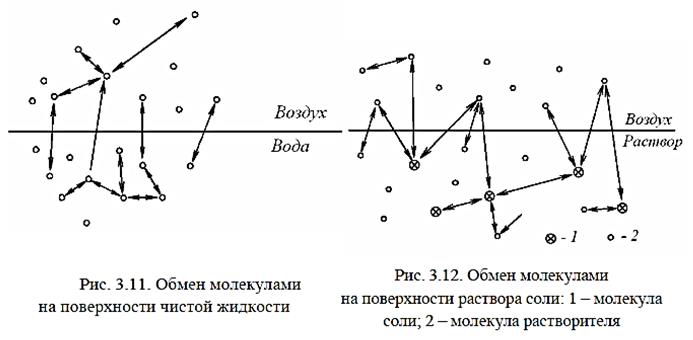
Поскольку в растворе молекулы растворителя испытывают притяжение не только между собой, но и с молекулами растворенного вещества, которые не обладают способностью покидать поверхность, то они в большей степени удерживаются в жидком растворе,
чем в чистой жидкости при одинаковых температурных условиях. Следовательно, над поверхностью раствора находится меньше молекул растворителя и парциальное давление паров, соответственно, ниже. Очевидно, чем выше содержание молекул растворенного вещества в жидкости, тем меньше парциальное давление паров растворителя над ее поверхностью.
Содержание растворенного вещества, %, оценивают его концентрацией
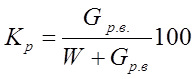
где G р в. – количество растворенного вещества; W – количество растворителя (воды).
|
|