
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторная работа № 10. Измерительные методы оценки качества товаров (химические методы)
|
|
Цель работы – ознакомиться с основными измерительными методами, изучить сущность методов и приобрести умения в выполнении классических методик по определению химического состава и пищевой ценностипищевых продуктов. Изучить сущность двух методов – определения жира (по Сокслету) и белка (по Кьельдалю). Уметь собрать и разобрать установки для определения жира и белка, запустить их в работу.
1. Определение жира по методу Сокслета
Метод основан на экстрагировании жира из продуктов c помощью органических растворителей в аппарате Сокслета с последующей отгонкой растворителей и вычислением массовой доли жира.
 Хорошими растворителями жира являются такие органические растворители, которые обладают невысокой температурой кипения: эфир этиловый и петролейный, хлороформ, четырёххлористый углерод и др.
Хорошими растворителями жира являются такие органические растворители, которые обладают невысокой температурой кипения: эфир этиловый и петролейный, хлороформ, четырёххлористый углерод и др.
Аппарат Сокслета (рисунок 1) состоит из приёмной колбы – 1, экстрактора – 2 и обратного холодильника – 3. Во время работы нижнюю часть экстрактора соединяют с горлышком колбы, а верхнюю (горловину) – с холодильником.
| Рисунок 1 – Аппарат Сокслета |
Колбу с растворителем нагревают на водяной бане, не допуская сильного кипения. Образующиеся при нагревании пары эфира по трубке Б поступают в экстрактор, а затем в холодильник, где конденсируются; капельно-жидкий эфир стекает в экстрактор, постепенно заполняя его и экстрагируя при этом жир из исследуемого материала. Как только в экстракторе уровень растворителя, насыщенного жиром, достигнет верхнего колена сифонной трубки и заполнит его, жидкость начнёт стекать в приёмную колбу, где растворитель снова испаряется, а извлечённый жир остаётся. Цикл повторяется столько раз, сколько необходимо для обезжиривания навески).
Техника определения. Для анализа отбирают навеску около 5 г, а в случае большого содержания жира в материале — около 2 – З г. Так как влага замедляет экстракцию, рекомендуется брать навеску после высушивания. Чтобы изготовить гильзу, кусок фильтровальной бумаги свёртывают в трубку на корпусе пробирки. Края бумажной трубки загибают, получают донышко. Чтобы из гильзы не высыпался материал, на дно её кладут немного ваты. После заполнения гильзы края другого конца также загибают. Длина гильзы должна быть такой, чтобы верхний край её в экстракторе оказался несколько ниже верхнего колена h сифонной трубки А.
В приёмную колбу, наливают эфир. Экстрактор соединяют с приёмной колбой и холодильником, в который подаётся вода. Экстракцию ведут в течение 6 ч при 6 – 10 сливах в час. Полноту извлечения жира проверяют, нанося каплю стекающего из экстрактора растворителя на фильтровальную бумагу. Если после испарения эфира на бумаге не остаётся жирного пятна, экстрагирование
закончено.
После извлечения из экстрактора гильзы высушивают сначала на воздухе, а затем в сушильном шкафу для удаления растворителя.
Массовую долю жира (х) в процентах определяют по формуле

где а – масса гильзы с материалом до экстрагирования, г;
b – масса гильзы с материалом после экстрагирования, г;
g – масса навески до высушивания, г.
2. Определение содержания белка по Кьельдалю
Метод основан на сжигании навески исследуемого образца в серной кислоте в присутствии перекиси водорода и определении общего азота кипячением минерализованной пробы с 20 см3 раствора гидроокиси натрия 0, 1 моль/дм3. При этом выделяющийся при разложении белковых компонентов аммиак химически связывается с серной кислотой. Разлагая полученный сульфат аммония при кипячении, делается вывод о содержании азота в навеске по количеству выделившейся серной кислоты, вступившей во взаимодействие с щёлочью.
Установка рабочего титра 20 см3 0, 1 моль/дм3 раствора гидроокиси натрия и проверка реактивов. Предварительно определяют количество гидроксида натрия в 20 см3 раствора 0, 1 моль/дм3 после кипячения по отношению к серной кислоте 0, 05 моль/дм3 и к добавляемым реактивам. Это количество условно наливают «рабочим титром щёлочи и обозначают Т. В коническую колбу вместимостью 500 см3 наливают 100 см3 дистиллированной воды, добавляют 1, 5 см3 концентрированной серной кислоты и 5 капель смешанного индикатора, содержащего равные объёмы спиртовых растворов метилового красного (0, 2%) и метиленового синего (0, 1%).
Содержимое колбы осторожно нейтрализуют раствором гидроксида натрия 150 г/дм3 до переходной окраски и подкисляют несколькими см3 раствора серной кислоты 0, 05 моль/дм3: вновь точно нейтрализуют раствором гидроксида натрия 0, 1 моль/дм3.
В колбу приливают из бюретки 20 см3 раствора гидроксида натрия 0, 1 моль/дм3, ставят на горящую плитку и кипятят 15 мин, считая с момента закипания, быстро охлаждают под краном или погружают в холодную воду.
Содержимое колбы нейтрализуют раствором серной кислоты 0, 05 моль/дм3 и добавляют избыток её 2 – 3 см3 для растворения карбонатов. Отмечают объём добавленного раствора серной кислоты.
Добавляют 2—3 капли смешанного индикатора и проводят обратное титрование раствором гидроксида натрия 0, 1 моль/дм3 до появления такой же окраски, какая была перед кипячением. «Рабочий титр» (Т) 20 см3 раствора гидроксида натрия 0, 1 моль/дм3 по отношению к раствору серной кислоты 0, 05 моль/дм3 вычисляют по формуле
Т = V1 · K1 – V2 · K2
где V1— объём раствора серной кислоты 0, 05 моль/дм3, прилитый в колбу после кипячения, см3;
K1 — поправочный коэффициент на точный раствор 0, 05 моль/дм3 серной кислоты;
V2 —объём раствора гидрокcида натрия 0, 1 моль/дм3, израсходованный на обратное титрование, см3;
K2 — поправочный коэффициент на точный раствор 0, 1 моль/дм3 гидроксида натрия.
Пример. Перед кипячением в колбу прилито 20 см3 раствора гидроксида натрия (К = 1). После кипячения добавлено 22 см3 раствора серной кислоты (К = 1). На обратное титрование пошло 2, 5 см3 раствора гидроксида натрия.
Т = 22 · 1 – (2, 5 · 1) = 19, 5.
Это свидетельствует о том, что при кипячении произошло снижение рабочего титра раствора гидроксида натрия вследствие возможного присутствия солей аммония в реактивах или под влиянием других факторов.
Проведение анализа. Навескумассой 0, 8—1, 4 г (для сухих продуктов) или 1, 8—2, 0 г для продуктов с высоким содержанием воды), отвешенных с абсолютной погрешностью не более 0, 0005 г, помешают в колбу Кьельдаля вместимостью 250 см3 и добавляют соответственно 20 или 10—12 см3 серной кислоты плотностью 1840 кг/м3 и 5 см3 перекиси водорода. Происходит саморазогревание смеси и выделение газов.
По окончании выделения газов колбу нагревают на песчаной бане до закипания серной кислоты, немного охлаждают, осторожно, по стенке колбы, добавляют 2—3 см3 перекиси водорода и продолжают нагревание. Добавление перекиси водорода с последующим нагреванием проводят несколько раз, постепенно уменьшая её количество.
По окончании минерализации (жидкость в колбе должна быть полностью обесцвечена) и охлаждения колбы, её содержимое количественно переносят в мерную колбу вместимостью 500 см3 при исследовании рыбной муки и 200 см3 при исследовании рыбы и рыбных продуктов с высоким содержанием воды. Объём жидкости в колбе доводят до метки дистиллированной водой и тщательно перемешивают содержимое.
Пипеткой отбирают 50 см3 приготовленного раствора, переносят в коническую колбу вместимостью 500 см3, добавляют 50 см3 дистиллированной волы и 5 капель смешанного индикатора.
Содержимое колбы осторожно нейтрализуют раствором гидроксида натрия 150 г/дм3 до переходной окраски, подкисляют несколькими см3 раствора серной кислоты 0, 05 моль/дм3, а затем вновь точно нейтрализуют раствором гидроокиси натрия 0, 1 моль/дм3.
После этого в колбу приливают из бюретки 20 см3 раствора гидроксида натрия 0, 1 моль/дм3 и ставят на горячую плитку. Содержимое колбы интенсивно кипятят точно 15 мин, считая с момента закипания, быстро охлаждают (под краном или погружают в холодную воду), нейтрализуют раствором серной кислоты 0, 05 моль/дм3 и добавляют избыток её 2—3 см3 для растворения карбонатов, отмечая количество добавленного раствора серной кислоты.
Добавляют 2—3 капли смешанного индикатора и проводят обратное титрование раствором гидроксида натрия 0, 1 моль/дм3 до появления такой же окраски, какая была перед кипячением.
Обработка результатов
Массовую долю белковых веществ (Х)в процентах вычисляют по формуле
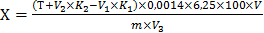 ,
,
где Т — «рабочий титр» 20 см3 раствора гидроксида натрия 0, 1 моль/дм3;
V — объём, в котором растворена минерализованная навеска, см3;
V1 — объём раствора серной кислоты 0, 05 моль/дм3, прилитый для нейтрализации и подкисления жидкости после её кипячения, см3;
V2 — объём раствора гидроксида натрия 0, 1 моль/дм3, израсходованный на обратное титрование избытка серной кислоты, см3;
V3 — объём раствора, взятый для кипячения, см3;
К1 — коэффициент пересчёта на точный 0, 05 моль/дм3 pacтвор серной
кислоты;
К2 — коэффициент пересчёта на точный раствор 0, 1 моль/дм3 гидроксида
натрия;
0, 0014 — количество азота, эквивалентное 1 см3 раствора гидроксида натрия 0, 1 моль/дм3 г;
6, 25 — коэффициент пересчёта азота на белковые вещества;
m — навеска муки, г.
За окончательный результат принимают среднее арифметическое значение результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0, 5%.
Вычисление проводят до второго десятичного знака.
Если предположить, что весь азот в исследуемом продукте находится в виде белковых веществ, то можно сделать пересчёт азота на белки. Для этого найденное количество азота в процентах умножают на 6, 25 (для пшеницы 5, 7). В данном случае принимают среднее содержание азота в белках – около 16%, а отсюда -  ; в белках пшеницы содержание азота составляет в среднем 17, 5%, поэтому коэффициент пересчета составит
; в белках пшеницы содержание азота составляет в среднем 17, 5%, поэтому коэффициент пересчета составит  .
.
Вопросы и задания для самоподготовки
1. С какой целью применяются инструментальные методы оценки качества пищевых продуктов?
2. Как классифицируются эти методы?
3. Что определяют с помощью физических и физико-химических методов?
4. Охарактеризуйте химические и биохимические методы анализа.
5. Для анализа каких продуктов используется микробиологические и физиологические методы?
6. В чём заключается специфика товароведного-технологических методов?
7. Какие приборы используются для различных инструментальных методов оценки качества пищевых продуктов?
8. На чём основаны химические методы определения белка (по Кьельдалю), жира (Метод Сокслета)?
|
|