
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Коагулирование примесей воды
|
|
Коагуляцией называется процесс укрупнения частиц дисперсной системы вследствие их взаимного слипания под действием сил межмолекулярного притяжения (сил Ван-дер-Ваальса) и электролитов.
Под коагулированием понимают комплекс мероприятий, сооружений и оборудования, обеспечивающих осуществление процесса коагуляции
Тонкодисперсные и коллоидные примеси воды образуют агрегативно-устойчивые системы, обладающие способностью противостоять слипанию частиц и сохранять дисперсное состояние. Для удаления таких примесей из воды необходимо нарушить их агрегативную устойчивость и создать условия для укрупнения частиц.
Устойчивость большинства частиц обусловлена наличием на поверхности электрического заряда одного знака (отрицательного), что препятствует их взаимному слипанию. Агрегативная устойчивость таких примесей легко нарушается снижением заряда частиц при введении в воду электролитов с ионами противоположного заряда (коагулянтов).
В практике очистки воды в качестве электролитов с ионами противоположного заряда (коагулянтов) широко применяются соли алюминия и железа: сернокислый алюминий Al2(SO4)3, хлорное железо FeCl3, железный купорос FeSO4, сульфат железа Fe2(SO4)3 и др.
При введении в воду коагулянта, например сернокислого алюминия, происходит диссоциация его молекул:
Al2(SO4)3 Û 2 Al3+ + 3SO42− .
Часть катионов Al3+ адсорбируется коллоидными и взвешенными веществами и снижает их заряд.
Другая часть гидролизуется с образованием малорастворимого гидроксида алюминия Al(OH)3.
Выделяющийся в процессе гидролиза ион водорода (Н+) снижает рН воды и замедляет процесс гидролиза и коагуляции, который может не дойти до образования Al(OH)3.
Если в воде имеется достаточный щелочной резерв, то ионы Н+ связываются гидрокарбонатными ионами:
Н+ + НСО3− = Н2О + СО2.
Для обеспечения полного гидролиза коагулянта при недостаточной щелочности исходной воды в нее добавляют подщелачивающий реагент, чаще всего известь или соду.
При добавлении извести Са(ОН)2 водород связывается ОН− ионом
Н+ + ОН− = Н2О
При добавлении соды Na2CO3 ионы водорода связываются карбонатными ионами в гидрокарбонатные
Н+ + СО32− = НСО3− .
Различают коагуляцию примесей воды в свободном объеме и контактную коагуляцию.
При коагуляции в свободном объеме после введения коагулянта осуществляется его быстрое смешение с водой в смесителях и последующее плавное перемешивание в камерах хлопьеобразования (флокуляции), где создаются условия для сближения и слипания частиц.
В результате такой коагуляции образуются крупные хлопья, которые удаляются из воды в отстойниках или флотаторах.
а)
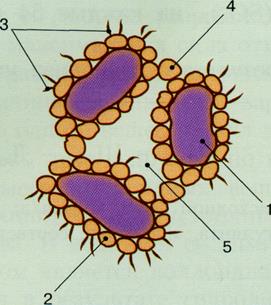

Структура хлопьев
а) – мутные воды; б) – маломутные воды; 1 – грубодисперсные частицы; 2 – частицы Al(OH)3; 3 – коллоидные примеси воды; 4 – соединительные мостики из Al(OH)3; 5 – защемленная вода.
Контактная коагуляция – это процесс адсорбции примесей воды с нарушенной агрегативной устойчивостью и коллоидных гидроксидов металлов коагулянта на поверхности крупных частиц контактной массы.
Метод основан на высоком эффекте взаимодействия частиц, значительно различающихся по своим размерам.
В качестве контактной массы используются зернистые материалы в плотном слое (контактные осветлители и контактные фильтры) или взвешенный слой ранее сформированного осадка (осветлители со взвешенным осадком).
При контактной коагуляции после смешения с коагулянтом вода сразу подается в зону контактной массы.
В процессе контактной коагуляции в результате прилипания примесей к контактной массе происходит их извлечение из воды с большойполнотой, тогда как в свободном объеме в результате коагуляции образуются хлопья, которые нужно затем извлекать из воды тем или иным методом, часто не одним, например, отстаиванием и фильтрованием.
Важнейшим фактором, определяющим эффективность процесса коагуляции, является подача в обрабатываемую воду требуемых количеств реагентов или, чаще говорят, оптимальных доз реагентов.
Под оптимальной дозой понимают минимальное количество активного продукта реагента, выраженное в мг/л или г/м3, необходимого для достижения требуемого эффекта процесса коагуляции.
Величина оптимальной дозы реагента зависит от содержания примесей воды, условий коагуляции и, достаточно точно, может быть определена экспериментально проведением по известным методикам технологического анализа на каждой конкретной воде.
При невозможности проведения технологического анализа приблизительные дозы коагулянта определяются в зависимости от цветности воды из выражения Дк = 4Ö Ц, мг/л и мутности (см. табл.16 СНиП 2.04.02-84). В качестве расчетной величины принимается большая величина из двух полученных доз.
Затем проверяется необходимость подщелачивания и определяется доза щелочного реагента из выражения
Дщ = Кщ (Дк/ек – Щисх + 1), мг/л
где Кщ – коэффициент щелочного реагента, который для извести равен 28, для соды – 53;
Дк – расчетная доза коагулянта, мг/л;
ек – эквивалентная масса коагулянта, мг/мг-экв;
Щисх – минимальная щелочность исходной воды, мг-экв/л.
При положительном результате расчета сразу определяется требуемая доза реагента. Отрицательный результат расчета говорит о том, что подщелачивания не требуется.
|
|