
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Глава 12. Биохимия питания и пищеварения 2 страница
|
|
Продуктом действия фосфолипазы А2, являющейся основной пищевари тельной фосфолипазой, являются чрезвычайно токсичные лизофосфатиды которые тут же гидролизуются лизофосфолипазой.
Фосфолипазы С и D завершают процесс гидролиза фосфоглицеридов Конечными продуктами их гидролиза являются глицерин, жирные кислоты 'неорганический фосфат и один из остаточных спиртов (холин, этаноламин, инозит, серии).
Гидролиз других пищевых фосфолипидов — сфингофосфатидов, а также
Таблица 25. Продукты переваривания пиши и их всасывание
|
гликолипидов менее изучен. Однако в стенке кишечника обнаружены ферменты сфингомиелиназа и церамидаза. Первый из них гндролизует связь, образованную фосфорной кислотой и сфингозином в сфингомиелинах, а второй — N-ацильную связь в молекуле церамида. Это ведет к освобождению сфингозина, жирной кислоты и фосфохолина.
Гидролиз стеридов. Поступающие с пищей эфиры холестерина, которыми богаты некоторые продукты (желток яиц, сливочное масло, икра и т. д.), расщепляются в эмульсионной капле кишечного содержимого с помощью панкреатической холестеролэстеразы. Активируется фермент также желчными кислотами. После действия фермента образуются свободный холестерин и жирные кислоты. Продукты гидролиза всех пищевых липидов всасываются в кишечнике.
4. Всасывание веществ в кишечнике
В кишечнике происходит всасывание продуктов переваривания питательных веществ (табл. 25).
Всасывание продуктов гидролиза белков. Основным продуктом гидролиза белков являются аминокислоты. Их всасывание в кишечнике, так же как и транспорт через другие клеточные мембраны, осуществляется с помощью специальных транспортных систем для аминокислот. Транспорт аминокислот является активным и требует необходимого градиента ионов Na+, создаваемого Na+. К+-АТФазой мембраны эпителия кишечника. Аминокислоты всасываются в кишечнике посредством вторичного активного транспорта. Это доказывается тем, что гликозид уабаин — ингибитор Na+, К+-АТФазы — тормозит и транспорт аминокислот.
Существует не менее пяти специальных систем переносчиков для аминокислот: 1) нейтральных алифатических; 2) циклических; 3) основных; 4) кислых; 5) пролина. Аминокислоты этих групп конкурируют за участки связывания с переносчиком соответствующей транспортной системы. При транспорте аминокислот через мембрану кишечного эпителия ион Na+ входит вместе с ними внутрь клетки, т. е. имеет место симпорт аминокислот и ионов Na+ специальной системой переносчйков. Натрий вновь «откачивается» из клетки №+, К+-АТФазой, а аминокислоты остаются внутри клетки.
Есть и другая разновидность механизма транспорта аминокислот через клеточную мембрану кишечного эпителия и других клеток — у-глута- мильный цикл. Перенос аминокислоты совершается с помощью специального фермента у-глутамилтрансферазы, который находится в мембране кишечного эпителия и других клеток. Кофактором этого фермента служит трипептид глутатион, которого достаточно много внутри клетки. На первом этапе фермент осуществляет перенос у-глутам ильного остатка глутатиона на транспортируемую аминокислоту:
Аминокислота Н- Глутаминнлцистеин ил глицин (глутатион) Г г л УЧ" " " Т " ис< ИР*, 3»> ► у-Глутамнламинокислота (дипептид) + Цистеивил глицин
Дипептид у-глутаминиламинокислота переходит внутрь клетки. Следовательно, для переноса аминокислоты из внешнего пространства внутрь клетки используется энергия пептидных связей глутатиона. Далее с помощью еще пяти внутриклеточных ферментов у-глутам ильного транспортного цикла происходит освобождение нз дипептида (у-глутамнламинокислота) свободной аминокислоты н ресинтез затраченной на транспорт молекулы глутатиона. Широкое распространение основного фермента этого транспортного цикла в тканях показывает его значение в транспорте аминокислот во многих клетках. В кишечнике возможно всасывание небольших количеств дипептидов и негидролизов а иных белков. Всасываются они путем пиноцитоза и внутри клетки гидролизуются протеиназамн лизосом.
У новорожденных низкая активность протеолитических ферментов и высокая проницаемость слизистой кишечника могут привести к всасыванию нативных белков пищи и вызвать повышенную чувствительность к ним организма. Очевидно, это является причиной пищевой аллергии, т. е. извращенной реакции организма на вещества, что ведет к непереносимости определенных продуктов. Обычно же всасываемые аминокислоты поступают в портальную вену, затем в печень и разносятся в кровь в растворенном виде по тканям и органам. Наиболее активно потребляют аминокислоты пёчень, почки и менее активно прочие органы, особенно головной мозг. Существует избирательность транспорта для отдельных аминокислот, особенно в клетках нервной системы. У новорожденных и- детей раннего возраста клеточные барьеры более проходимы, поэтому даже в головной мозг аминокислоты проходят очень быстро.
Всасывание продуктов гидролиза полинуклеотидов происходит путем пассивного или облегченного транспорта. Наряду с азотистыми основаниями через мембраны хорошо проникают и нуклеозиды. Поэтому в виде нуклеозидов всасывается часть продуктов переваривания нуклеиновых кислот.
Всасывание моносахаридов как продуктов переваривания углеводов происходит посредством вторичного активного транспорта. Транспорт моносахаридов зависит от ионов Na+, за счет градиента которого (как и при всасывании аминокислот) осуществляется их перенос с помощью специального переносчика.
Скорость всасывания отдельных моносахаридов—гексоз, пентоз, неодинакова. Наиболее быстро всасывается галактоза, затем глюкоза. Всосавшиеся моносахариды поступают, из кишечной стенки в портальную вену, в печень и разносятся с кровью к остальным тканям. В печени остальные гектазы (галактоза, фруктоза, манноза) превращаются в глюкозу или ее метаболиты. Главными потребителями глюкозы помимо печени являются головной мозг, скелетные мышцы, где глюкоза используется в качестве легкого окисляемого источника энергии. В жировой ткани глюкоза используется для синтеза нейтрального жира.
Обычно около 65% глюкозы, поступившей при всасывании из кишечника, расходуется на окисление в клетках (для образования энергии), на синтез жира около 30% и 5% на синтез гликогена. Эти пропорции меняются в зависимости от физиологического состояния организма, возраста и ряда других причин.
Всасывание продуктов гидролиза липидов и их транспорт. Всасывание продуктов переваривания липидов имеет свои особенности. Так, всасывание жирных кислот зависит от длины углеводородной цепи. Короткоцепочечные.жирные кислоты -(до 10—12 углеродных атомов) транспортируются простой диффузией внутрь кишечного эпителия. Длинноцепочечные жирные кислоты (более 14 углеродных атомов) образуют транспортные комплексы с желчными кислотами. Эти комплексы называют холеиновыми кислотами. В таком виде жирные кислоты проходят через мембрану кишечного эпителия. Можно считать, что это облегченный транспорт, где роль переносчика выполняют желчные кислоты. Внутри стенки кишечника холеиновый комплекс распадается, и желчные кислоты уходят в кровь портальной вены и в печень. Из печени они вновь возвращаются с желчью в кишечник. Этот кругооборот называют кишечно- печеночной циркуляцией желчных кислот.
Частично липиды всасываются в виде три ацилглицеринов (около 3 — 6%) путем пиноиитоза и значительная часть (до 50%) — в виде 2-моноацил- глицерииов. Последние переходят мембранный барьер простой диффузией.
Кроме того, легко всасываются глицерин, фосфаты в виде натриевых и калиевых солей, холин и другие спирты, сфингозин и холестерин. Часть продуктов неполного гидролиза фосфолнпидов, например фосфатидилхолин, тоже всасываются в кишечнике. Особенности транспорта их еще неясны, хотя частично они всасываются путем пассивного транспорта, а для некоторых из них обнаружены переносчики,
Продукты переваривания липцдов, поступившие в слизистую кишечника в результате всасывания, транспортируются в кровь и лимфу. Такие продукты гидролиза липидов, как короткоцепочечные жирные кислоты, глицерин, фосфаты, холин и другие спирты глйцерофосфатидов, хорошо растворимы и поступают из слизистой кишечника в кровь воротной вены и далее в печень. Некоторая часть продуктов неполного гидролиза фосфолнпидов (глицеро- фосфохолин, глнцеролфосфат), всосавшихся из кишечника, также обнаружи- вается'в крови воротной вены.
Длинноцепочечные жирные кислоты, холестерин, некоторая доля всосавшихся трнацилглицеринов, моноацилглицерины и большая часть переваренных фосфолнпидов обнаруживаются в лимфе. Однако' прежде чем поступить в лимфу, в кишечной стенке липиды подвергаются р е с и н р.е? у. 186
В эпителии кишечника наблюдается ресинтез триацилглицеринов, фосфолнпидов и эфиров холестерина.
Биологическая роль ресинтеза липидов состоит в том, что в стенке кишечника образуются липиды, более свойственные организму человека, а не пищевому жиру, который может резко отличаться по - физико-хими- ческнм показателям от липидов человека.
Источником ресинтеза триацилглицеринов служат глицерин, моноацил- глицерин, поступившие в клетку в ходе всасывания, и жирные кислоты. Поскольку все отличия в составе триацилглицеринов определяются составом жирных кислот, то при ресинтезе липидов используются собственные жирные кислоты с длинной цепью, образовавшиеся в самом кишечном эпителии из предшественников. Лишь часть всосавшихся жирных кислот пригодна для ресинтеза и тоже используется в этом процессе.
То же самое происходит при ресинтезе фосфолнпидов и эфиров холестерина. На их сборку тоже идут жирные кнслоты, свойственные данному виду организма. Примерно 70% свободного холестерина, поступившего при всасывании, расходуется на образование эфиров холестерина.
Транспорт ресинтезированных в кишечнике липидов происходит следующим образом. Некоторая часть фосфолнпидов, образовавшихся при ресинтезе, поступает в кровь воротной вены благодаря их гидрофильности. Остальные фосфолипиды, все триацил глицерины, эфиры холестерина и свободный холестерин переносятся с лимфой. Ввиду их нерастворимости перенос осуществляется с помощью транспортных форм липидов (см. гл. «Смешанные макромолекулы»).
Ресинтезнрованные" в кишечнике лнпиды транспортируются в составе хиломикронов. Белковая-часть их — аполипопротеид — образуется в эпителии кишечника. Формируются хнломикроны из аполнпопротенда, придающего им растворимость, и ресинтезированных липидов, основную долю которых, около 90%, составляют триацнлглицерины. Кроме того, в них входят фосфолипиды, эфиры холестерина и свободный холестерин. Негидролизованные триацнлглицерины, которые попадают в кишечник, также входят в хнломикроны вместе с ресинтезнрованными триацил глицеринами.
Хнломикроны переходят из эпителия кишечника в грудной лимфатический проток. При приеме большого количества жирной пищи лимфа приобретает молочнообразный вид от взвешенных хиломикронов. Из грудного лимфатического протока хнломикроны поступают в кровь, которая становится мутной, резко опалесцирующей (такая плазма крови называется липемической). В крови хиломикроны, а точнее, входящие в них триацнлглицерины, расщепляются липопротеидлипазой. Этот фермент образуется в печени, жировой ткани, легких, эндотелии сосудов и т. д. в неактивном виде. Активируется ои кофактором — гепарином. В ответ на поступление хиломикронов в кровь из тучных клеток соединительной ткани туда поступает гепарин, активирующий липопротеидлиЬазу. Последняя гидролизует триацилглицерины в составе хиломикронов на глицерин и жирные кислоты. В результате этого хиломикроны распадаются и плазма крови просветляется.
Жирные кислоты тут же акцептируются альбуминами плазмы и доставляются к тканям и органам. Глицерин находится в растворимом виде й тоже с током крови поступает к органам. Основная часть жирных кислот и глицерина потребляется жировой тканью где происходит депонирование их в виде триацилглицеринов, а также сердцем, печенью и другими органами, в которых они окисляются для энергетических целей.
5. Регуляция пищеварения
Переваривание компонентов пищи регулируется системой гор моноподобных веществ, образующихся в клетках пищеварительного тракта. Характеристика их дана в табл. 26. Химическое строение большинства из них неизучено. Известно, что гистамин является продуктом декарбоксилирования гистидина, а гастрин, секретин и холецистокинин, выделенные в очищенном виде, относятся к полипепгидам. Остальные регуляторы пищеварения, очевидно, тоже пептиды, но они не получены в чистом виде и названы по вызываемому ими эффекту.
Выделение регуляторов происходит под действием пищи и определяется ее составом. При поступлении пищи в желудок выделяются гистамин и гастрин, которые обеспечивают секрецию соляной кислоты и пепсина, переваривающих белки. Переход желудочного содержимого в двенадцатиперстную кишку служит сигналом к выделению энтерогастрона, который, выделяясь в кровь, тормозит секрецию желудочного сока.
Таблица 26. Регуляторы пищеварения и их характеристика
|
Поступление пиши в кишечник способствует выделению комплекса регуляторов (секретин, холецистокинин-панкреозимин, хиЦодекин и энтерокринин), которые обеспечивают быстрое выделение панкреатического и кишечного соков для переваривания пищи. Нарушение секреции регуляторов вызывает дисгармонию процессов переваривания пищи.
6. Патология переваривания и всасывания
Нарушение пищеварения вызывается недостатком ферментов и кофакторов переваривания пищи и биохимическими или механическими нарушениями процессов всасывания веществ в кишечнике
Нарушения переваривания белков. Пониженная секреция соляной кислоты и пепсина (так называемый гипоацидный гастрит) вплоть до полного ее отсутствия (это состояние называется ахиллия) существенно не влияет на общую перевариваемость белков пищи. Этот недостаток компенсируется необходимым набором протеолитических ферментов при кишечном пищеварении. Однако отсутствие соляной кислоты приводит к развитию микробной флоры и гнилостным процессам в желудке.
Дефицит протеолитических ферментов поджелудочной железы (врожденное отсутствие или механическое препятствие) приводит к выделению непереваренных белков с калом и относительному белковому голоданию. Непереваренные белки подвергаются перевариванию микроорганизмами толстого кишечнику. Этот процесс называется гниением белков в кишечнике. Гниение белков сопровождается образованием ядовитых продуктов — сероводорода, аминов (путресцин, кадаверин, фенилэтнламнн, нндолэтиламин), фенола, крезола, скатола, индола. Эти вещества могут оказать отрицательное действие на организм. Некоторые из этих вредных продуктов обезвреживаются здесь же в кишечнике, остальные — при всасывании, главным образом в печени.
Нарушения переваривания липидов наблюдаются при недостатке образования липолитических ферментов в поджелудочной железе или вследствие нарушения оттока панкреатического сока. Почти те же нарушения в переваривании липидов, что и дефицит липолитических ферментов, вызывают нарушение желчеобразования в печени и оттока желчи в кишечник, поскольку желчные кислоты выполняют роль эмульгаторов, активаторов липолитических ферментов и переносчиков жирных кислот. Основным " признаком патологии переваривания липидов является стеаторея, т. е. выделение непереваренных липидов с калом, который принимает белый цвет из-за большого количества непереваренного жира.
Нарушения переваривания углеводов проявляются при недостатке (врожденном или приобретенном) амилолитических ферментов — а-амилазы или олигосахаридаз. Основным признаком этой патологии служит непереносимость отдельных углеводов, например крахмала (при дефиците а-амилазы), лактозы (при дефиците лактазы), реже мальтозы (при дефиците мальтазы) и т. д.
Очень часто наблюдается непереносимость лактазы, сопровождающаяся кишечными расстройствами. Наблюдается она у детей, вскармливаемых в течение длительного времени грудным молоком. Количество лактозы, потребляемой ребенком, может превышать возможности лактазы кишечника, и оставшаяся непереваренной лактоза вызывает кишечные расстройства и поддерживает развитие микробов кишечника. Переход на молочные смеси с ограниченным содержанием лактозы избавляет ребенка от недуга. У многих взрослых людей, а у аборигенов Австралии в 100% случаев наблюдается возрастная недостаточность лактазы, а с ней и непереносимость молока. Бывает и наследственный" дефект лактазы, встречающейся у'детей, который сопровождается теми же симптомами.
Нарушения всасывания продуктов переваривания пищи возмЬжны после оперативных вмешательств, т. е- удаления большой части тонкого кишечника или при повреждении транспортных систем тонкого кишечника. Всасывание жирных кислот нарушается при отсутствии или дефиците желчных кислот. Всасывание глюкозы (и других моносахаридов) и аминокислот определяется работой «натриевого насоса» елизисгий кишечника и наличием специфических переносчиков. Всякие нарушения в работе Na+, К+ -АТФазы (врожденный дефект, поступление ингибиторов ее и т. п.) препятствует нормальному вса- > сыванню аминокислот и моносахаридов. Возможны признаки слабого всасывания соответствующих аминокислот при дефектах одной нз пяти групп специальных переносчиков. Для моносахаридов вероятен аналогичный исход при дефектах переносчиков. При отравлении глнкозидом флоридзином, являющимся мощным ингибитором переносчика моносахаридов, прекращается всасывание моносахаридов, хотя градиент иона Na+ не нарушается.
Б. БИОЭНЕРГЕТИКА
Энергетические ресурсы, имеющиеся в распоряжении клеток, используются для обеспечения их энергетических потребностей. К энергетическим ресурсам можно отнести: моносахариды, аминокислоты,.глицерин и жирные кислоты, которые, проходя через плазматическую мембрану клеток, могут или сразу использоваться как источники энергии, или, включаясь в состав биополимеров (полисахариды, липиды, белки), образуют как бы внутриклеточное депо энергетических веществ. По мере надобности внутриклеточные биополимеры расходуются на образование энергии. В целом организме роль отдельных тканей и органов в накоплении энергетических ресурсов, особенно таких ценных, как жиры и углеводы, неодинакова. Жировая ткань обладает наибольшими возможностями для накопления энергетически важных триа- цилглицеринов по сравнению с другими клетками н тканями. В этом заложен определенный биологический смысл для организма, так как если бы все ткани одинаково аккумулировали жир для своих энертетических целей, то, отягощенные накопившимся жиром, они не могли бы выполнять другие функции. Жировая ткань снабжает другие ткани энергетическими субстратами — глицерином и жирными кислотами, которые поступают в кровь после распада триацилглицерина жировой ткани. Похожую роль, только в ограниченных размерах, выполняет печень, снабжая другие клетки и ткани глюкозой, которая поступает в кровь при распаде гликогена печени. Однако запасы гликогена в печени невелики по сравнению с запасами жира в жировой ткани. Если же: при патологии в печени накапливаются излишки гликогена или того же жира, то это мешает выполнению специализированных функций клетками печени.
В целом энергетические потребности животных клеток, клеток растений, пребывающих в темноте, и многих микроорганизмов удовлетворяются за счет освобождения энергии при катаболизме питательных веществ.
1. Фазы освобождения энергия из питательных веществ
В ходе извлечения энергии из различных субстратов можно условно выделить три фазы. Первая фаза — подготовительная. Она необходима для перевода биополимеров, поступающих с пищей или находящихся внутри клетки, в удобную для извлечения энергии форму — мономеры. Осуществляется эта фаза с помощью гидролаз в кишечнике или внутри клети. Внутри клетки гидролиз происхоит с участием ферментов цитоплазмы и лизосом. Энергетической ценности эта фаза не представляет, так как освобождается лишь до 1% энергии субстратов, до и она рассеивается в форме теплоты.
Вторая фаза — частичный распад мономеров до ключевых промежуточных продуктов, главным образом до ацетил-КоА и нескольких кислот цикла Кребса — оксалоацетата, 2-оксоглутарата. Во второй фазе большое число исходных субстратов сокращается до трех. Для нее характерно час-.тимное (до 20%) освобождение энергии, заключенной в исходных субстратах, происходящее в анаэробных (бескислородных) условиях. Часть этой энергии аккумулируется в фосфатных связях АТФ, а часть рассеивается в виде теплоты. Превращение мономеров протекает в гиалоплазме, а заключительные реакции — в митохондриях.
Третья фаза — окончательный распад веществ до С02» Н20 с участием кислорода. Эта фаза — аэробного биологического окисления веществ протекает с полным освобождением энергии. Особенность превращения веществ на этом этапе состоит в том, что из трех метаболитов предыдущей фазы, после- так называемого цикла Кребса, остается только водород, связанный с переносчиками (НАД или ФАД). Водород — универсальное энергетическое топливо, которое используется в дыхательной цепи для образования АТФ и воды. Примерно $0% всей энергии химических связей веществ освобождается в данной фазе. Эта энергия окисления субстратов сосредоточивается в фосфатных связях АТФ и часть ее выделяется н виде теплоты. Все реакции этой фазы локализуются в митохондриях.
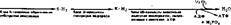
|
| Здесь SH2 — субстрат окисления; КН2 — водород, связанный с коферментом. Задача ферментативных процессов первого блока — образование необходимых Субстратов окисления, соответствующих имеющемуся в клетке окис- |
Освобождение энергии в живой клетке осуществляется постепенно, благодаря этому на различных этапах ее выделения она может аккумулироваться в удобной для клетки химической форме, в виде АТФ. Весь энергетический аппарат клетки устроен как бы из трех блоков, имеющих разное функциональное назначение (т. е. осуществляющих три группы процессов):
лительному ферменту. Одновременно происходит частичная аккумуляция энергии расщепляемых субстратов в фосфатных связях АТФ. Дальнейшие превращения субстратов связаны с процессами биологического окисления.
2. Биологическое окисление
Реакции биологического окисления катализируются ферментами. Окисление может быть связано: 1) с отщеплением водорода от окисляемого субстрата (дегидрирование); 2) с потерей электрона; 3) с присоединением- кислорода. Все три типа реакций равнозначны и имеют место в живой клетке.
Процесс окисления не протекает изолированно, он сопряжен с реакцией восстановления, т. е. с присоединением водорода или электрона. Оба вещества — окисляемое и восстанавливаемое, образуют окислительно-восстановительную парусили редокс-пару.
Окислительную или восстановительную способность разных соединений характеризует их сродство к электрону. Чем легче субстрат отдает электроны, тем сильнее его восстанавливающая способность. Наоборот, высокое сродство к электрону характеризует их окисляющую способность. Способность любой окислительно-восстановительной пары к реакциям восстановления характеризуется стандартным окислительно-восстановительным потенциалом, или ре- докс-потенциалом. Он выражается значением электродвижущей снлы (в вольтах), возникающей в полуэлементе, в котором окислитель и восстановитель присутствуют в концентрации 1, 0 моль/л при 25°С л рН 7, 0 и находятся в равновесии с электродом, который может обратимо принимать электроны от восстановителя. Стандартный редокс-потенциал отражает восстанавливающую активность редокс-пары и обозначается знаком £ 0. В качестве нулевого стандарта принят редокс-потенциал газообразного водорода при давлении--191, 3 кПа (I атм), концентрации ионов Н+ в растворе 1, 0 моль/л, т. е. при рНО, температуре 25°С. Стандартный редокс-потенцнал этой окислительно-восстановительной пары согласно уравнению Н2**2Н + +2е- условно принят за нуль. При физиологическом значении рН 7, 0, при котором измеряются стандартные редокс-потенциалы всех окислительно-восстановительных пар, редокс-потенцнал системы Н2/2Н * + 2е~ равен —0, 42 В. Отрицательное значение его указывает на выраженные восстановительные свойства. Чем более отрицателен редокс-потенцнал, тем сильнее выражена способность данной редокс-пары отдавать электроны, т. е. играть роль восстановителя. Напротив, чем более положителен редокс-потенцнал, тем более выражена способность данной редокс-пары принимать электроны, т. е. играть роль окислителя. Например, редокс-потенцнал пары НАД • Н + Н + /НАД+ равен — 0, 32 В, что говорит о высокой способности ее отдавать электроны, а редокс - потенциал пары '/г^г/НгО имеет большую положительную величину +0, 81 В, поэтому у кислорода наивысшая способность принимать электроны.
|
|